
- DAZ.online
- DAZ / AZ
- DAZ 1-2/2020
- Gecheckt: Tabakrauch
Gecheckt
Gecheckt: Tabakrauch
Interaktionen erkennen und vermeiden
Rauchtabak ist trotz rückläufiger Konsumentenzahlen nach wie vor eine der am häufigsten genutzten Genussdrogen. Laut Statistischem Bundesamt liegt der mittlere Pro-Kopf-Verbrauch an Zigaretten, Zigarren, Zigarillos und Co. für 2019 bei 900 Stück je Einwohner und Jahr [1]. Laut einer kürzlich durchgeführten repräsentativen Umfrage bei mehr als 12.200 Menschen rauchen im Mittel 28% der deutschen Bevölkerung (32% der Männer, 25% der Frauen), wobei erhebliche Unterschiede zwischen den Bundesländern zu bestehen scheinen (z. B. 18% in Hessen, aber 44% in Brandenburg) [2]. Hierbei ist insbesondere besorgniserregend, dass trotz Werbeverbot (bereits seit 2007) und Etablierung der drastischen Warnhinweise auf Tabakwaren im Rahmen der Umsetzung der EU-Tabakrichtlinie (seit 2016) etwa 12% der Jugendlichen, 35% der jungen Erwachsenen und etwa 38% der 25- bis 39-Jährigen rauchen. Zu sehr ähnlichen Ergebnissen kommen eine Analyse auf Grundlage des Epidemiologischen Suchtsurveys (ESA) 2018 [3], das Jahrbuch Sucht 2019 [4] und der Drogen- und Suchtbericht 2019 der Bundesregierung [5]. Demnach muss in Deutschland von etwa 14,4 Millionen Rauchern unter der deutschen Erwachsenenbevölkerung ausgegangen werden.
Problematische Verbrennungsprodukte
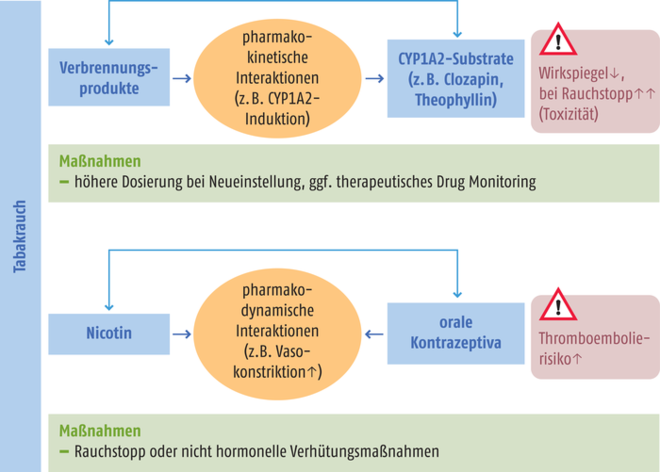
Es ist gut dokumentiert, dass langfristiges Tabakrauchen das Risiko für zahlreiche ernste Erkrankungen wie chronisch-obstruktive Lungenerkrankung (COPD), Arteriosklerose, koronare Herzerkrankung, Demenz sowie einer Vielzahl an Tumorerkrankungen deutlich erhöht und auch mit einer erheblichen Verkürzung der Lebenszeit assoziiert ist. Verantwortlich für die langfristig schädigende Wirkung des Rauchens sind neben dem eigentlich pharmakologisch wirksamen und für den leichten Rausch verantwortlichen Nicotin die Verbrennungsprodukte. Dazu zählen polyzyklische aromatische Kohlenwasserstoffe (PAK), Nitrosamine, aromatische Amine, Dioxine, Formaldehyd, Acrolein, Benzol und Schwermetalle wie Cadmium. Einige dieser Substanzen sind zudem in der Lage, die Elimination von Arzneistoffen maßgeblich zu beeinflussen. Gerade bei bestehender Medikation mit Arzneistoffen, die in dieser Hinsicht sensible pharmakokinetische Abbauwege nutzen und gleichzeitig eine geringe therapeutische Breite aufweisen, ist Vorsicht geboten, da die Wirksamkeit und Sicherheit der Arzneimitteltherapie beeinflusst werden kann. Des Weiteren können in einigen Fällen auch pharmakodynamische Interaktionen auftreten, so dass die Arzneimittelwirkung abgeschwächt werden kann bzw. Nebenwirkungen verstärkt werden können. Patienten sollten auf derartige Risiken hingewiesen werden.
Pharmakokinetische Interaktionen
Insbesondere die im Tabakrauch enthaltenen PAK wie Benzo[a]pyren können einige für den Arzneistoffmetabolismus relevante Enzyme wie das Cytochrom P450 (CYP) 1A1, CYP1A2 und die UDP-Glucuronosyltransferase (UGT) 1A1, UGT1A3, UGT1A4 und UGT1A6 stark induzieren [6]. Der Mechanismus dieser Induktion ist ähnlich wie bei anderen induktiven Wechselwirkungen [7]: Durch die Aktivierung von nukleären Rezeptoren, welche nach Bindung exogener Liganden als Transkriptionsfaktoren wirken, wird die Proteinbiosynthese der besagten Enzyme insbesondere in der Leber massiv gesteigert. Der verantwortliche nukleäre Rezeptor ist hierbei der aromatic hydrocarbon receptor (AhR), der neben dem Tabakrauch auch von PAK aus stark gegrillten Nahrungsmitteln aktiviert wird [6]. Für die Pharmakotherapie ist hierbei vor allem das CYP1A2 von Bedeutung, das etwa 3 bis 5% der auf dem Markt befindlichen Arzneimittel abbaut [8, 9]. Hierzu zählen unter anderem Antipsychotika (Clozapin, Haloperidol, Olanzapin, Ziprasidon), Antidepressiva (Agomelatin, Duloxetin, Amitriptylin, Mirtazapin, Citalopram), Neuropharmaka (Ropinirol, Rasagilin, Tacrin, Tizanidin), kardiovaskuläre Arzneistoffe (Apixaban, Carvedilol, Propranolol, Verapamil, Triamteren), Methylxanthine (Theophyllin, Pentoxifyllin, Coffein) und Östrogene wie Estradiol. Klinisch bedeutsame Interaktionen wurden hierbei insbesondere bei Stoffen mit intensiver und nahezu ausschließlich über CYP1A2 vermittelter Biotransformation beobachtet. Die Tabelle fasst wesentliche Interaktionen zusammen.
Wirkstoffe | Rauchstatus (Zigaretten/Tag) | pharmakokinetische Änderung | Referenz |
|---|---|---|---|
Clozapin | starke Raucher (7 bis > 20) | Serumspiegel um 50% reduziert, p = 0,058 | 19 |
Duloxetin | ? | Serumspiegel um 53% reduziert, p < 0,05 | 20 |
Estradiol | starke Raucher (> 5) | endogene Estradiol-Spiegel um 43% reduziert, p < 0,01 | 21 |
Mirtazapin | ? | Serumspiegel um 41% reduziert, p < 0,03 | 22 |
Olanzapin | leichte Raucher (1 bis 4) | AUC0-120h um 45% reduziert, p < 0,05; Cmax um 26% reduziert, n. s. | 23 |
starke Raucher (> 5) | AUC0-120h um 67% reduziert, p < 0,05; Cmax um 61% reduziert, p < 0,001 | 23 | |
starke Raucher (7 bis > 20) | Serumspiegel um 67% reduziert, p < 0,01 | 19 | |
Propranolol | ? | Serumspiegel um 25% reduziert, p < 0,05 | 24 |
Theophyllin | ? | Clearance um 58 bis 100% erhöht, Halbwertszeit um 63% reduziert | 10 |
Verapamil | starke Raucher (> 5) | Serumspiegel und AUC um 20% reduziert, p < 0,05 | 25 |
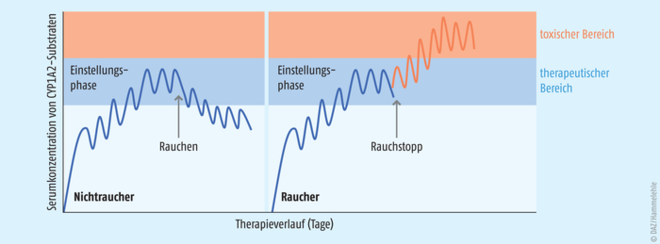
In allen dargestellten Beispielen nimmt die Serumexposition der Wirkstoffe im Vergleich zu Nichtrauchern merklich ab, wobei eine Reduktion der Area under the curve (AUC) bzw. der maximalen Serumspiegel (Cmax) unter 80% in der Regel als klinisch relevante Interaktion angesehen wird (s. Abb. „Schematische Darstellung der Einflüsse des Rauchens und des Rauchstopps“). Am intensivsten wurde hierbei der Einfluss auf Theophyllin untersucht. Starke Raucher zeigen eine etwa halbierte Halbwertszeit und benötigen etwa die doppelte Dosis an Arzneistoff als Nichtraucher [10, 11]. Auch wenn Theophyllin heute bei Asthma und COPD immer seltener eingesetzt wird, sind die erhobenen Daten ein gutes exemplarisches Beispiel für die Einflüsse des Rauchens auf ein starkes CYP1A2-Substrat.
Abb.: Schematische Darstellung der Einflüsse des Rauchens und des Rauchstopps auf die Pharmakokinetik von CYP1A2-Substraten. Im Vergleich zu Nichtrauchern ist die Serumexposition bei Rauchern verringert. Wird das Rauchen während des Therapieverlaufs aufgegeben, kann es zu einem starken Anstieg der systemischen Arzneistoffkonzentration kommen.
Regelmäßige Raucher benötigen aufgrund ihrer höheren CYP1A2-Aktivität für derartige Stoffe bei Neueinstellung also etwas höhere Arzneistoffdosierungen als Nichtraucher. Dies ist bisher jedoch für viele der genannten CYP1A2-Substrate nur unzureichend untersucht worden. Als zweifelhaften Vorteil weisen Raucher deutlich weniger arzneimittelbedingte Nebenwirkungen auf [10, 11]. Es ist jedoch zu befürchten, dass dies lediglich die Folge subtherapeutischer Serumspiegel ist. Lediglich im Bereich der Antipsychotika werden die Patienten routinemäßig unter Nutzung des therapeutischen Drug Monitorings (TDM) auf eine adäquate Dosierung eingestellt [12].
CYP1A2 wird dosisabhängig durch die PAK des Tabaks induziert, wobei der Konsum von einer bis fünf, sechs bis zehn bzw. mehr als zehn Zigaretten pro Tag die CYP1A2-Aktivität um den Faktor 1,2; 1,5 bzw. 1,7 erhöht [13]. Der volle Induktionseffekt liegt bereits bei einem täglichen Konsum von zehn Zigaretten vor und klingt etwa drei Tage nach Rauchstopp wieder ab [13, 14]. Ein Rauchstopp kann für Patienten problematisch werden, die während bestehender Pharmakotherapie mit Arzneistoffen mit geringer therapeutischer Breite regelmäßig rauchen, während des Therapieverlaufs dann aber mit dem Rauchen aufhören. Hierdurch können die systemischen Arzneistoffkonzentrationen steigen. Es drohen vermehrt Nebenwirkungen oder gar Toxizität der Arzneistoffe (s. Abb. „Schematische Darstellung der Einflüsse des Rauchens und des Rauchstopps“). In diesem Zusammenhang wurden beispielsweise Fälle von Agranulozytose oder Krampfanfälle bei Clozapin-Therapie berichtet [12, 15]. Vorsicht wäre ebenso geboten bei Olanzapin, Theophyllin, Duloxetin, Tacrin und Tizanidin, da hier jeweils erhebliche Störwirkungen auftreten können [16]. Da Nicotin selbst keinerlei induktive Effekte auf Stoffwechselenzyme aufweist, ist dieses Szenario auch dann zu fürchten, wenn bei einem Rauchstopp auf Substitutionspräparate oder E-Zigaretten zurückgegriffen wird [17].
Pharmakodynamische Effekte
Die möglichen pharmakodynamischen Wechselwirkungen werden dagegen hauptsächlich durch das im Tabakrauch enthaltene Nicotin verursacht. Sie können somit auch beim Gebrauch von E-Zigaretten oder bei einer Nicotin-Substitution auftreten. Für Patienten mit kardiovaskulären Vorerkrankungen wie Atherosklerose oder koronarer Herzerkrankung stellt Nicotin einen Risikofaktor dar. Als ZNS- und ganglienwirksames Alkaloid erhöht es einerseits den Blutdruck und die Herzfrequenz, zudem wirkt Nicotin vasokonstriktiv. Dieser Effekt scheint insbesondere bei hohen Nicotin-Spitzenspiegeln zum Tragen zu kommen, wie sie bei Tabakrauchen zusätzlich zu einer bestehenden Nicotin-Substitution auftreten können. In derartigen Fällen wurden Herzinfarkte und Schlaganfälle berichtet [10, 11, 18]. Des Weiteren schwächt Nicotin durch die Freisetzung von Catecholaminen im zentralen Nervensystem und der Peripherie auch die Wirkung von Betablockern und Benzodiazepinen ab.
Die vasokonstriktive Komponente des Nicotins kann zudem die Freisetzung von subkutan verabreichten Biologika wie Insulin ungünstig beeinflussen. Auch scheint die Wirkung von inhalativen Glucocorticoiden zur Asthmatherapie über bisher unklare Mechanismen abgeschwächt zu sein.
Eine der relevantesten möglichen Interaktionen stellt das erhöhte Thromboembolierisiko bei Raucherinnen dar, die zeitgleich orale Kontrazeptiva einnehmen. Während das Risiko für einen kardiovaskulären Todesfall bei nicht rauchenden Frauen mit oralen Kontrazeptiva zwischen 0,65 (15 bis 34 Jahre) und 6,21 (35 bis 44 Jahre) pro 100.000 liegt, erhöht sich dieses Risiko bei Raucherinnen etwa um das Fünffache [10, 11, 18]. Über dieses Risiko sollten alle Raucherinnen aufgeklärt werden. Frauen über 35 Jahren, die orale Kontrazeptiva einnehmen, sollte daher dringend vom Rauchen abgeraten werden oder eine andere, nichthormonelle Methode der Empfängnisverhütung empfohlen werden. |
Literatur
[1] Statistisches Bundesamt, 2019. Fachserie 14: Finanzen und Steuern, Reihe 9.1.1: Absatz von Tabakwaren 2018
[2] Kotz D et al. Nutzung von Tabak und E-Zigaretten sowie Methoden zur Tabakentwöhnung in Deutschland. Dtsch Arztebl Int 2018;115:235-242
[3] Atzendorf J et al. Gebrauch von Alkohol, Tabak, illegalen Drogen und Medikamenten. Dtsch Arztebl Int 2019;116:577-584
[4] Deutsche Hauptstelle für Suchtfragen (DHS) e. V. DHS Jahrbuch Sucht 2019
[5] Drogen- und Suchtbericht 2019. www.drogenbeauftragte.de
[6] Tolson AH. PXR and CAR. Adv Drug Deliv Rev 2010;62(13):1238-1249
[7] Oswald S. Gecheckt: Orale Kontrazeptiva – Interaktionen mit Induktoren von Enzymen und Transportern erkennen und vermeiden. Dtsch Apoth Ztg 2019;45:31-33
[8] Böhm R et al. Arzneimittel und CYP1A2 – Klinisch relevante Inhibition und Induktion des Enzyms. Dtsch Apoth Ztg 2013;22:44-49
[9] Zanger UM. Cytochrome P450 enzymes in drug metabolism: regulation of gene expression, enzyme activities, and impact of genetic variation. Pharmacol Ther 2013;138(1):103-141
[10] Zevin S et al. Drug interactions with tobacco smoking – An update. Clin Pharmacokinet 1999;36(6):425-438
[11] Kroon LA. Drug interactions with smoking. Am J Health Syst Pharm 2007;64(18):1917-1921
[12] Hiemke C et al. Consensus Guidelines for Therapeutic Drug Monitoring in Neuropsychopharmacology: Update 2017. Pharmacopsychiatry 2018;51(1-02):9-62
[13] Faber MS et al. Time response of cytochrome P450 1A2 activity on cessation of heavy smoking. Clin Pharmacol Ther 2004;76(2):178–184
[14] Faber MS et al. Assessment of CYP1A2 activity in clinical practice: Why, how, and when? Basic Clin Pharmacol Toxicol 2005;97(3):125–134
[15] Chochol MD et al. Clozapine-Associated Myoclonus and Stuttering Secondary to Smoking Cessation and Drug Interaction: A Case Report. J Clin Psychopharmacol 2019;39(3):275-277
[16] Chui CY et al. Prevalence and recognition of highly significant medication-smoking cessation interactions in a smoke-free hospital. Drug Alcohol Depend 2019;200:78-81
[17] Kocar T et al. Switching From Tobacco Smoking to Electronic Cigarettes and the Impact on Clozapine Levels. J Clin Psychopharmacol 2018;38(5):528-529
[18] Lucas C et al. Smoking and drug interactions. Aust Prescr 2013;36:102-104
[19] Haslemo T et al. The effect of variable cigarette consumption on the interaction with clozapine and olanzapine. Eur J Clin Pharmacol 2006;62(12):1049–1053
[20] Fric M et al. The influence of smoking on the serum level of duloxetine. Pharmacopsychiatry 2008;41(4):151-155
[21] Cassidenti DL et al. Short-term effects of smoking on the pharmacokinetic profiles of micronized estradiol in postmenopausal women. Am J Obstet Gynecol 1990;163:1953-1960
[22] Lind AB et al. Steady-state concentrations of mirtazapine, N-desmethylmirtazapine, 8-hydroxymirtazapine and their enantiomers in relation to cytochrome P450 2D6 genotype, age and smoking behaviour. Clin Pharmacokinet 2009;48(1):63-70
[23] Wu TH et al. Pharmacokinetics of olanzapine in Chinese male schizophrenic patients with various smoking behaviors. Prog Neuropsychopharmacol Biol Psychiatry 2008;32(8):1889-1893
[24] Fox K et al. The interaction of cigarette smoking and beta-adrenoceptor blockade. Br J Clin Pharmacol 1984;17 Suppl 1:92S-93S
[25] Fuhr U et al. Effects of grapefruit juice and smoking on verapamil concentrations in steady state. Eur J Clin Pharmacol 2002;58(1):45-53





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.