
- DAZ.online
- DAZ / AZ
- DAZ 43/2019
- Abstoßung verhindern
Apotheker auf Station
Abstoßung verhindern
Supra- und subtherapeutische Tacrolimus-Spiegel nach Herztransplantation vermeiden
Da in der Pharmakotherapie von Transplantationspatienten Wirkstoffe mit enger therapeutischer Breite und großem Interaktionspotenzial eingesetzt werden, Dosierungen häufig individuell an Organfunktionen angepasst werden und das Auftreten von unerwünschten Arzneimittelwirkungen besonders überwacht werden sollte, ist eine Ergänzung des interdisziplinären Teams aus Herzchirurgen, Kardiologen, Mikrobiologen und Pflegekräften mit Stationsapothekern sinnvoll, die hier ihre pharmazeutische Perspektive einbringen können.
Der Fall
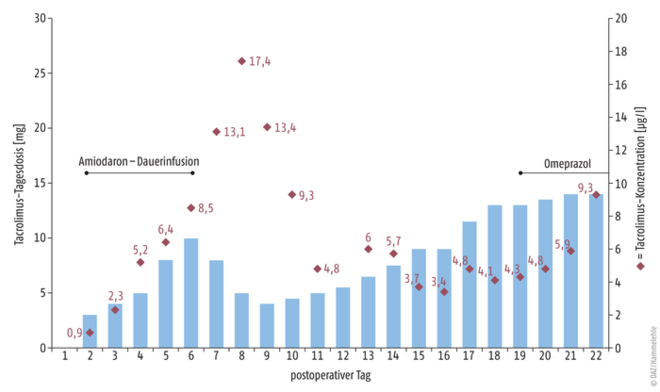
Ein 55 Jahre alter Herztransplantations(HTX)-Patient unter Therapie mit Tacrolimus, Mycophenolat und Methylprednisolon zeigte unmittelbar nach Transplantation und Beginn der oralen Tacrolimus-Titration (Zielbereich 10 bis 12 μg/l) hohe Spiegel von 17 μg/l (Tag 8) (Abb. 1). In der Folge des Spiegelanstieges wurde von ärztlicher Seite bereits ab Tag 7 die Tacrolimus-Dosis reduziert, da durch die lange Tacrolimus-Halbwertszeit ein weiterer Konzentrationsanstieg erwartet und ein niedriger Tacrolimus-Bedarf angenommen wurde. Jedoch lagen die Tacrolimus-Spiegel an den folgenden Tagen 11 – 19 im subtherapeutischen Bereich und zeigten trotz steter Dosiserhöhung keine steigende Tendenz (Abb. 1).
Um in der Hochrisiko-Phase unmittelbar nach der Transplantation das Risiko für Abstoßungen zu senken, ist es jedoch besonders wichtig, schnellstmöglich adäquate Tacrolimus-Spiegel aufzubauen. Während der interdisziplinären Visite stellte sich an Tag 19 die Frage, ob und welche pharmakotherapeutischen Faktoren ursächlich für die niedrigen Spiegel infrage kommen könnten und ob andere Möglichkeiten zur Verfügung ständen, um den Zielbereich von 10 bis 12 μg/l zu erreichen.
Strukturiertes Vorgehen / Medikationsanalyse
Kurzbeschreibung des Patienten
Es handelt sich um einen 55-jährigen HTX-Patienten, der vor 19 Tagen transplantiert und jetzt auf die Normalstation verlegt wurde. Zuvor war der Patient für zwei Jahre mit einem mechanischen Herzkreislauf-Unterstützungs-System bei einer höchstgradigen, globalen Herzinsuffizienz (linksventrikuläre Ejektionsfraktion 15%) versorgt worden, die sich als Folge eines akuten Koronarsyndroms entwickelt hatte. Weitere Diagnosen lauten:
- Hyperlipidämie
- Zustand nach transitorischer ischämischer Attacke
- chronische Niereninsuffizienz
- Hepatopathie mit leichtgradig erhöhten Transaminasen.
Die Laborwerte sind in Tabelle 1, die Medikation in Tabelle 2 aufgeführt.
Laborwert | Wert | Einheit | Referenz |
|---|---|---|---|
Natrium | 141 | mmol/l | 135 – 146 |
Kalium | 4,11 | mmol/l | 3,4 – 4,8 |
Calcium (korrigiert) | 2,17 | mmol/l | 2,1 – 2,65 |
Kreatinin | 1,65 ! | mg/dl | 0,6 – 1,2 |
GFR (MDRD) | 44,6 | ml/min/1,73 m2 | > 60 |
Harnstoff | 46 ! | mg/dl | < 40 |
Glucose | 78 | mg/dl | 65 – 110 |
Kreatinkinase | 48 | U/l | < 190 |
Kreatinkinase-MB | 12 | U/l | < 6% CK |
Laktatdehydrogenase | 331 ! | U/l | < 317 |
Glutamat-Oxalacetat-Transaminase (GOT) | 20 | U/l | < 46 |
Glutamat-Pyruvat-Transaminase (GPT) | 39 | U/l | < 50 |
Alkalische Phosphatase (AP) | 80 | U/l | < 40 – 130 |
Gamma-Glutamyltransferase (GGT) | 457 ! | U/l | < 60 |
Cholinesterase (CHE) | 7,07 | kU/l | 5,32 – 12,92 |
Bilirubin, gesamt | 0,30 | mg/dl | < 1,0 |
Bilirubin, direkt | 0,20 | mg/dl | < 0,3 |
Harnsäure | 7,2 ! | mg/dl | < 7 |
Triglyceride | 255 | mg/dl | < 150 |
Cholesterin | 256 | mg/dl | altersabhängig |
Gesamteiweiß | 57,6 | g/l | 60 – 80 |
Albumin | 33,7 | g/l | 30 – 50 |
C-reaktives Protein (CRP) | 8,6 | mg/l | < 5 |
Leukozyten | 6,54 | /nl | 4 – 10 |
Erythrozyten | 3,5 | /pl | 4,3 – 6,1 |
Hämoglobin | 10,5 | g/dl | 13 – 17 |
Einflussfaktoren auf die Tacrolimus-Pharmakokinetik
Bei der Interpretation von Tacrolimus-Spiegeln und Dosisempfehlungen müssen verschiedenste Faktoren berücksichtigt werden, die die Pharmakokinetik von Tacrolimus beeinflussen können.
Tacrolimus kann in retardierten und unretardierten Darreichungsformen verordnet werden, welche sich in der Bioverfügbarkeit unterscheiden, wobei für Herztransplantationen nur die unretardierte Darreichungsform zugelassen ist. Auf Ebene der Resorption beeinflusst die zeitgleiche Einnahme mit fettreicher und kohlenhydratreicher Nahrung das Ausmaß der Resorption und kann zu niedrigeren Spitzenspiegeln führen [1]. Zusätzlich ist bei der Resorption zu berücksichtigen, dass Tacrolimus ein Substrat von Cytochrom-P (CYP) 3A4/5 und des Effluxtransporters p-Glykoprotein ist. Dadurch wird der Wirkstoff bereits aktiv in den Enterozyten metabolisiert und aus diesen transportiert, was zur insgesamt niedrigen und individuellen Bioverfügbarkeit beiträgt [2, 3].
Neben der initialen Verstoffwechselung in den Enterozyten findet der Großteil des CYP3A4/5-vermittelten Metabolismus von Tacrolimus in der Leber statt, so dass die Tacrolimus-Clearance durch verschiedene CYP-Inhibitoren und CYP-Induktoren gesenkt bzw. erhöht werden kann [2, 3]. Neben p-Glykoprotein ist Tacrolimus auch Substrat des Organic-Anion-Transporting Polypeptid C, welches an der Aufnahme in die Leber und der biliären Sekretion beteiligt ist [4]. Die beschriebene Enzym- und Transporteraktivität kann weiter durch unterschiedliche pharmakogenetische Ausprägungen (u. a. Polymorphismen) variieren, die sich zwischen verschiedenen Ethnien unterscheiden und die Tacrolimus-Pharmakokinetik beeinflussen können [5, 6]. Beispielsweise zeigen Patienten, die bestimmte CYP3A5-Varianten im Darmepithel exprimieren, eine deutlich niedrigere Bioverfügbarkeit [4, 6, 7].
In der frühen postoperativen Phase können zusätzlich diverse andere Einflussfaktoren zu einer Variabilität in der Tacrolimus-Clearance führen. So kann beim Vorliegen einer Cholestase (Marker einer potenziellen hepatischen Dysfunktion) die Clearance vermindert sein [3]. Andererseits wiederum kann das Vorliegen einer Anämie oder auch einer Hypoalbuminämie die freie Tacrolimus-Fraktion erhöhen, da Tacrolimus zum größten Teil (85 – 95%) an Erythrozyten oder an Plasmaproteine gebunden ist. Dies führt zu einer gesteigerten Tacrolimus-Aufnahme in die Leber, sodass vermehrt Tacrolimus metabolisiert wird und die Tacrolimus-Spiegel sinken [3, 8].
Wirkstoff und Stärke | Dosierung | Indikation | |
|---|---|---|---|
Enoxaparin 40 mg | s.c. | 0-0-1-0 | Thromboseprophylaxe |
Flucloxacillin 2 g | i.v. | 1-1-1-1 | Wundinfektion |
Tacrolimus 6,5 mg | p.o. | 1-0-1-0 | Immunsuppression |
Mycophenolat 1500 mg | p.o. | 1-0-1-0 | Immunsuppression |
Methylprednisolon 40 mg | p.o. | 1-0-0-0 | Immunsuppression |
Cotrimoxazol 960 mg | p.o. | 1-0-0-0 | Toxoplasmose- und Pneumocystis-Prophylaxe |
Valganciclovir 450 mg | p.o. | 1-0-0-0 | CMV-Prophylaxe |
Pantoprazol 40 mg | p.o. | 1-0-0-0 | Ulkusprophylaxe |
Magnesium 243 mg | p.o. | 1-0-1-0 | Prophylaxe Tacrolimus-bedingter Hypomagnesiämien |
Pravastatin 10 mg | p.o. | 0-0-1-0 | Vaskulopathie-Prophylaxe |
Metamizol 500 mg | p.o. | 1-1-1-1 | Schmerzen |
Torasemid 10 mg | p.o. | 2-2-0-0 | Periphere Ödeme |
Kalium 8 mmol | p.o. | 3-3-3-0 | Kaliumsubstitution |
Mirtazapin 30 mg | p.o. | 0-0-0-1 | Depression |
Nystatin 10.000 I.E/ml Suspension | p.o. | 1-1-1-0 | Pilzprophylaxe |
Individuelle Analyse
Im Rahmen der Medikationsanalyse sollten die oben aufgeführten Punkte berücksichtigt und strukturiert analysiert werden. Auf Patientenebene und in Rücksprache mit den zuständigen Pflegekräften wurden das Stellen der richtigen Darreichungsform, die korrekte Einnahme mit zeitlichem Abstand zu fettreicher Nahrung, Probleme beim Schlucken der Kapseln und eine Non-Adhärenz abgeklärt, jedoch konnten hier keine Auffälligkeiten identifiziert werden.
Auf pharmakotherapeutischer Ebene konnten an Tag 19 keine relevanten Interaktionen identifiziert werden, die die aktuell niedrigen Spiegel erklären könnten. Prinzipiell kann eine längerfristige Therapie mit hochdosierten Glucocorticoiden höhere Tacrolimus-Dosierungen notwendig machen (möglicherweise durch eine CYP-Induktion). Weil die Tacrolimus-Spiegel aber trotz deutlicher Dosiserhöhungen kaum anstiegen und der Patient nach der Operation keine Methylprednisolon-Stoßtherapie erhalten hatte, erschien dies jedoch nicht als alleiniger ausschlaggebender Faktor plausibel [9, 10]. Der Hämoglobin-Wert und das Albumin waren postoperativ zwar erniedrigt, zeigten sich aber konstant, weshalb eine erhöhte Clearance auf der Basis einer erhöhten freien Tacrolimus-Fraktion als alleinige Ursache der niedrigen Spiegel ausgeschlossen wurde.
Generell empfiehlt es sich, bei der Interpretation von Arzneimittelspiegeln den Verlauf zu betrachten und mögliche Fehlabnahmen oder Missinterpretationen auszuschließen. In diesem speziellen Fall wurden die Dosierungen wegen des initialen Tacrolimus-Anstiegs auf 13 – 17 μg/l (Tag 7 + 8) reduziert, da eine niedrige Clearance angenommen wurde (Abb. 1). Jedoch könnte dieser Anstieg auch durch andere Ursachen, wie eine Fehlabnahme zu einem späteren Zeitpunkt (kein Talspiegel) oder auch Interaktionen, bedingt sein. Da der Spiegelverlauf stetig anstieg und gleichmäßig fiel, erschien eine Fehlabnahme, die sich eher als punktuell erhöhter Spiegel darstellen würde, unwahrscheinlich. Zusätzlich stieg in diesem Zeitraum das Serumkreatinin als Zeichen einer möglichen Tacrolimus-vermittelten akuten Nephrotoxizität an, was als weiterer Indikator für valide abgenommene Spiegel angesehen wurde.
Zum Zeitpunkt des Anstiegs erhielt der Patient jedoch wegen postoperativer Rhythmusstörungen Amiodaron als Dauerinfusion (Tag 2 – 6), welches über die Inhibition von CYP3A4 und p-Glykoprotein den Tacrolimus-Metabolismus hemmen kann und so den deutlichen Anstieg der Tacrolimus-Konzentration ausgelöst haben könnte [11, 12]. Als Folge des Konzentrationsanstiegs wurden die Tacrolimus-Dosierungen gesenkt, zeitgleich (Tag 6) wurde aber auch die Amiodaron-Dauerinfusion abgesetzt, da der Patient mittlerweile wieder einen stabilen Sinusrhythmus hatte und von ärztlicher Seite die Indikation für eine Amiodaron-Therapie nicht mehr gegeben war.
Durch die gesteigerte Clearance resultierten dann im Verlauf vermutlich die niedrigen Tacrolimus-Spiegel trotz einer steigenden Dosis.
Theoretisch könnte die CYP-Inhibition wegen der langen Amiodaron-Halbwertszeit nach dessen Absetzen weiter fortbestehen. Eine mögliche Erklärung für das Abfallen der Spiegel trotz der langen Amiodaron-Halbwertszeit könnte im großen Amiodaron-Verteilungsvolumen und der hohen Proteinbindung liegen [13]. Entsprechend dieser Annahme wäre während der Dauerinfusion ausreichend Amiodaron intravasal für eine Inhibition der CYP-Enzyme und p-Glykoprotein verfügbar, welches sich nach dem Absetzen in tiefere Kompartimente umverteilte und dann während der Rückverteilung und Elimination aus diesen Kompartimenten nicht mehr in ausreichender Konzentration vorlag, um die Tacrolimus-Clearance weiter maßgeblich zu inhibieren.
Ausgehend von diesen Punkten wurde angenommen, dass der Patient wahrscheinlich über eine hohe Tacrolimus-Clearance verfügte, die zuerst durch die CYP-Inhibition mit Amiodaron erniedrigt war, sodass die Tacrolimus-Dosisreduktion nicht notwendig gewesen wäre.
Lösungsansatz
Theoretisch könnten mithilfe einer Genotypisierung potenzielle Polymorphismen identifiziert werden, die der hohen Clearance zugrunde liegen könnten. Die Kenntnis möglicher Polymorphismen würde zwar Hinweise zur Ursache geben, allerdings das akute Problem der erniedrigten Spiegel nicht lösen und weiter würde die Dauer der Diagnostik die kritische Phase möglicher subtherapeutischer Spiegel verlängern.
Theoretisch stünde mit dem Tacrolimus-Präparat Envarsus® eine neue Darreichungsform zur Verfügung, die auf der Basis der sogenannten MeltDose®-Technologie im Vergleich zu schnell freisetzendem Tacrolimus eine bis zu 40% höhere Bioverfügbarkeit aufweist [14]. Jedoch ist dieses Präparat bis jetzt nur bei Leber- und Nierentransplantationspatienten zugelassen, und es finden sich nur vereinzelte Daten zur Anwendung bei HTX-Patienten, sodass ein Präparatewechsel und Off-Label-Use in dieser Situation nicht vertretbar erschien.
Ausgehend von dem Anstieg der Tacrolimus-Spiegel unter der Amiodaron-Therapie wurde zusätzlich zu einer weiteren Dosissteigerung die Möglichkeit eines Boosterings durch eine selektive Inhibition des Tacrolimus-Metabolismus im interdisziplinären Team erwogen. Hierzu wären Inhibitoren notwendig, die im besten Fall nur selektiv Einfluss auf den Tacrolimus-Metabolismus nehmen würden und die Clearance der anderen Arzneimittel unbeeinflusst ließen. Vereinzelte Fallberichte berichten eine Interaktion zwischen Omeprazol und Tacrolimus, in deren Folge es zu einer erhöhten Exposition kam. Der Mechanismus dieser Interaktion ist nicht vollständig geklärt, es wird eine Inhibition von CYP3A4 und p-Glykoprotein diskutiert, die von der Ausprägung unterschiedlicher Genotypen abhängig ist [15, 16]. Da Omeprazol ein geringes Interaktionspotenzial mit der bestehenden Medikation aufwies, wurde beschlossen, vor einer möglichen Umstellung der Immunsuppression den Versuch eines Boosterings mit Omeprazol durchzuführen und wenn notwendig die Dosierung weiter anzuheben. Ab Tag 19 wurde Pantoprazol 40 mg durch Omeprazol 40 mg 1-0-1 ersetzt. Ab Tag 20 stiegen die Tacrolimus-Spiegel an, sodass an Tag 22 ein Spiegel von 9,3 μg/l gemessen werden konnte und in den folgenden Tagen schließlich der Zielbereich von 10 – 12 μg/l nach einer geringen Dosiserhöhung erreicht wurde.
Fazit und wichtige Konsequenzen
Tacrolimus ist ein Wirkstoff mit enger therapeutischer Breite, dessen Pharmakokinetik wie zuvor beschrieben auf verschiedensten Ebenen beeinflusst werden kann. Nicht nur im klinischen Alltag, sondern insbesondere in der ambulanten Weiterbetreuung muss dies von Ärzten, Apothekern und auch den Patienten berücksichtigt werden.
Als Teil des lokalen Versorgungsnetzwerks ist es daher in der öffentlichen Apotheke besonders wichtig, in der Beratung und bei der Abgabe neu verordneter Arzneimittel an Transplantationspatienten einen Einfluss auf die Tacrolimus-Pharmakokinetik abzuschätzen und diesen wenn notwendig an die behandelnden Ärzte zu kommunizieren. Wirkstoffe mit Einfluss auf die Tacrolimus-Konzentration sind hierbei bekannte Inhibitoren von CYP3A4 und p-Glykoprotein, z. B. Azolantimykotika, Makrolidantibiotika, Amiodaron oder Induktoren, wie z. B. Phenytoin, Carbamazepin, Johanniskraut oder Rifampicin. Die Auswirkung von Interaktionen ist dabei teils auch von der Expression der CYP-Enzyme und der verschiedenen Genotypen abhängig, weshalb bei Unsicherheit über mögliche Auswirkungen neuer Arzneimittel eine Spiegelkontrolle im Verlauf erwogen werden sollte. Generell kann ein Großteil der Interaktionen meist durch frühzeitige Dosisanpassungen und regelmäßige Spiegelbestimmungen kontrolliert werden, sofern nicht ohnehin alternative Wirkstoffe mit einem geringeren Interaktionspotenzial zur Verfügung stehen. Wenn Patienten neu aufgetretene Symptome wie Somnolenz, Übelkeit, Verwirrtheit, Tremor, Oligurie und Anurie berichten, sollte auch an einen möglichen erhöhten Tacrolimus-Spiegel gedacht und der Zeitpunkt der letzten Spiegelkontrolle sowie neu angesetzte Arzneimittel abgeklärt werden [16, 17].
Außerdem sollte in der Beratung der Patienten berücksichtigt werden, dass eine koordinierte Einnahme zu den Mahlzeiten stattfindet. Tacrolimus sollte am besten nüchtern eingenommen werden, um eine optimale Bioverfügbarkeit zu gewährleisten. Sollten Patienten Tacrolimus immer mit einer Mahlzeit einnehmen und dabei im angestrebten Zielbereich liegen, dann sollte dies beibehalten werden, um das Risiko zu hoher Tacrolimus-Spiegel bei nüchterner Einnahme zu senken.
Weiter sind die Patienten darauf hinzuweisen, dass auch das Trinken von Grapefruitsaft zu einer Erhöhung der Spiegel führen kann. Neuere Fallberichte und Untersuchungen in Tiermodellen zeigen, dass auch die übermäßige Einnahme von Kurkuma, Ingwersaft oder Pomelosaft die TacrolimusSpiegel erhöhen kann [18 – 20].
Dieses Fallbeispiel verdeutlicht, welchen Mehrwert die Integration von Apothekern in multidisziplinären Behandlungsteams haben kann. Das Gesamtbild des Patienten wird durch den Fokus auf die Arzneimittel in der pharmazeutischen Betrachtung von Patienten um zusätzliche klinisch relevante Aspekte ergänzt und erweitert. Dabei kann es sich um wichtige Hinweise zur korrekten Einnahme von Arzneimitteln bis hin zur Interpretation komplexerer Interaktionen handeln, die im besten Fall in einer interdisziplinären und sektorenübergreifenden Zusammenarbeit adressiert werden, damit eine bestmögliche Patientenversorgung erreicht werden kann. |
Literatur
[1] Bekersky I, Dressler D, Mekki QA. Effect of low- and high-fat meals on tacrolimus absorption following 5 mg single oral doses to healthy human subjects. J Clin Pharmacol 2001;41(2):176-82. doi: 10.2165/00003088-200241110-00003
[2] Christians U, Jacobsen W, Benet LZ et al. Mechanisms of clinically relevant drug interactions associated with tacrolimus. Clin Pharmacokinet 2002;41(11):813-51. doi: 10.2165/00003088-200241110-00003
[3] Sikma MA, van Maarseveen EM, van de Graaf EA et al. Pharmacokinetics and toxicity of tacrolimus early after heart and lung transplantation. Am J Transplant 2015;15(9):2301-13. doi: 10.1111/ajt.13309
[4] Elens L, Capron A, Kerckhove VV et al. 1199G>A and 2677G>T/A polymorphisms of ABCB1 independently affect tacrolimus concentration in hepatic tissue after liver transplantation. Pharmacogenet Genomics 2007;17(10):873-83. doi: 10.1097/FPC.0b013e3282e9a533
[5] Goto M, Masuda S, Kiuchi T et al. CYP3A5*1-carrying graft liver reduces the concentration/oral dose ratio of tacrolimus in recipients of living-donor liver transplantation. Pharmacogenetics 2004;14(7):471-8. doi:
[6] Staatz CE, Goodman LK, Tett SE. Effect of CYP3A and ABCB1 single nucleotide polymorphisms on the pharmacokinetics and pharmacodynamics of calcineurin inhibitors: Part I. Clin Pharmacokinet 2010;49(3):141-75. doi: 10.2165/11317350-000000000-00000
[7] Storset E, Holford N, Hennig S et al. Improved prediction of tacrolimus concentrations early after kidney transplantation using theory-based pharmacokinetic modelling. Br J Clin Pharmacol 2014;78(3):509-23. doi: 10.1111/bcp.12361
[8] Zahir H, McLachlan AJ, Nelson A et al. Population pharmacokinetic estimation of tacrolimus apparent clearance in adult liver transplant recipients. Ther Drug Monit 2005;27(4):422-30. doi:
[9] Hesselink DA, Ngyuen H, Wabbijn M et al. Tacrolimus dose requirement in renal transplant recipients is significantly higher when used in combination with corticosteroids. Br J Clin Pharmacol 2003;56(3):327-30. doi: 10.1046/j.0306-5251.2003.01882.x
[10] Shihab FS, Lee ST, Smith LD et al. Effect of corticosteroid withdrawal on tacrolimus and mycophenolate mofetil exposure in a randomized multicenter study. Am J Transplant 2013;13(2):474-84. doi: 10.1111/j.1600-6143.2012.04327.x
[11] Nalli N, Stewart-Teixeira L, Dipchand AI. Amiodarone-sirolimus/tacrolimus interaction in a pediatric heart transplant patient. Pediatr Transplant 2006;10(6):736-9. doi: 10.1111/j.1399-3046.2006.00561.x
[12] Kisters K, Cziborra M, Funke C et al. Amiodarone-tacrolimus interaction in kidney transplantation. Clin Nephrol 2008;70(6):563. doi: 10.5414/cnp70563
[13] Aventis S. Fachinformation – Cordarex 200 mg Tabletten. 2016.
[14] Chiesi. Fachinformation Envarsus 0,75 mg Retardtabletten. 2016.
[15] Takahashi K, Yano I, Fukuhara Y, et al. Distinct effects of omeprazole and rabeprazole on the tacrolimus blood concentration in a kidney transplant recipient. Drug Metab Pharmacokinet 2007;22(6):441-4. doi:
[16] Moreau C, Debray D, Loriot MA et al. Interaction between tacrolimus and omeprazole in a pediatric liver transplant recipient. Transplantation 2006;81(3):487-8. doi: 10.1097/01.tp.0000194861.59543.b9
[17] Maguire M, Franz T, Hains DS. A clinically significant interaction between tacrolimus and multiple proton pump inhibitors in a kidney transplant recipient. Pediatr Transplant 2012;16(6):E217-20. doi: 10.1111/j.1399-3046.2011.01559.x
[18] Nayeri A, Wu S, Adams E et al. Acute calcineurin inhibitor nephrotoxicity secondary to Turmeric Intake: A Case Report. Transplant Proc 2017;49(1):198-200. doi: 10.1016/j.transproceed.2016.11.029
[19] Egashira K, Sasaki H, Higuchi S et al. Food-drug interaction of tacrolimus with pomelo, ginger, and turmeric juice in rats. Drug Metab Pharmacokinet 2012;27(2):242-7. doi:
[20] Egashira K, Fukuda E, Onga T et al. Pomelo-induced increase in the blood level of tacrolimus in a renal transplant patient. Transplantation 2003;75(7):1057. doi: 10.1097/01.TP.0000058545.35041.BE


































0 Kommentare
Das Kommentieren ist aktuell nicht möglich.