
- DAZ.online
- DAZ / AZ
- DAZ 12/2017
- CAR-T-Zelltherapien gegen...
Arzneimittel und Therapie
CAR-T-Zelltherapien gegen Krebs im Aufwind
Erfolgsgeschichte trotz aktuellem Misserfolg
Der amerikanische Krebsforscher Carl H. June, der als Vater der Immunonkologie mithilfe von CAR-T-Zellen gilt, lobt in einem aktuellen Review deren Entwicklung in den letzten zehn Jahren als „success story“. Das Prinzip ist folgendes: Dem Versuchstier bzw. Patienten werden T-Lymphozyten entnommen, denen ex vivo mithilfe von γ-Retroviren der Code für die Synthese von CAR eingeschleust wird. Dann werden die CAR-T-Zellen denselben Tieren bzw. Patienten infundiert und vermehren sich in ihnen weiter.
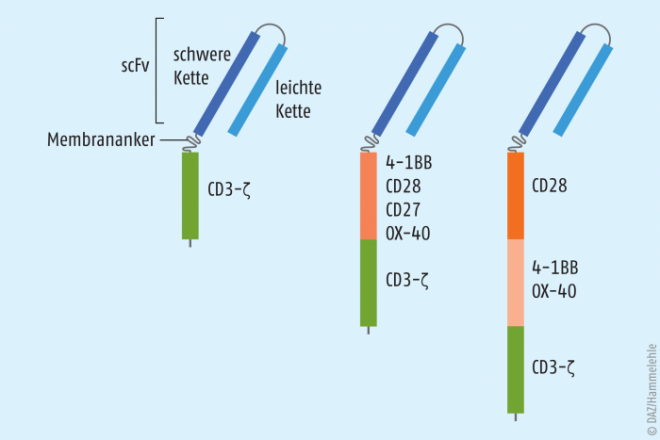
Inzwischen gibt es bereits die dritte CAR-Generation (s. Grafik). Die ersten CAR enthielten drei Bauteile verschiedenen Ursprungs (deshalb „chimär“):
- extrazellulär die variablen Fragmente der leichten und schweren Kette von Antigenrezeptoren auf B‑Lymphozyten (single chain variable fragments, kurz „scFv“); dieses Bauteil bindet spezifisch an Oberflächenproteine von Tumorzellen wie CD19 oder CD20;
- einen „Anker“ zur stabilen Lokalisation des CAR in der Zellmembran und
- intrazellulär das Signalmolekül CD3 mit angehängter ζ-Kette von T-Zell-Rezeptoren; bei einem Antigen-Kontakt des scFv gibt CD3-ζ den Befehl, den Fas-Liganden zu aktivieren und die zytolytischen Perforine und Granzyme zu sezernieren, die gemeinsam die kontaktierte Krebszelle vernichten.
Diese CAR-T-Zellen wirkten zwar in vitro, aber nicht im Patienten. Erst die Ergänzung von CD3-ζ durch einen kostimulatorischen Baustein brachte einen Erfolg, und ein weiterer Baustein im CAR steigerte den Effekt nochmals. Diese Bestandteile verbessern neben der Signalübertragung auch die Proliferation und die Lebensdauer der CAR-T-Zellen.
Kürzlich wurde die Phase-II-Studie ROCKET zur CAR-T-Zelltherapie von Patienten mit Akuter Lymphatischer Leukämie abgebrochen, nachdem fünf Teilnehmer aufgrund überschießender Immunreaktionen gestorben waren (Produkt JCAR015, Fa. Juno Therapeutics). Das Problem, dass die CAR-T-Zellen, wenn sie ihre eigentliche Aufgabe erledigt haben, weiterhin Zytokine ausschütten und das Immunsystem überstimulieren, ist nicht neu; man nennt es „cytokine release syndrom“ (CLS). Deshalb wurden bereits vor der ROCKET-Katastrophe CAR-T-Zellen mit einem zusätzlichen inhibitorischen CAR entwickelt. Andere Forscher experimentieren derweil mit CAR-T-Zellen, die durch den Einbau der Checkpoint-Inhibitoren Tremelimumab und Nivolumab einen zweiten Wirkmechanismus erhalten haben.
Eine andere Lösung des CLS-Problems besteht darin, statt des etablierten Gentransfers mit γ-Retroviren das CRISPR/Cas9-Verfahren zu verwenden. Dadurch gelang es, den Code für die Synthese von CAR im Genom der T-Zelle so zu platzieren, dass er durch Transkriptionsfaktoren unter Kontrolle gehalten wird. Die CAR-T-Zelle ist deshalb nur noch aktiv, wenn sie mit Tumorzellen Kontakt hat. |
Quellen
Johnson LA, June CH. Driving gene-engineered T cell immunotherapy of cancer. Cell Res 2017;27:38-58
Zhang E, Xu H. A new insight in chimeric antigen receptor-engineered T cells for cancer immunotherapy. J Hematol Oncol 2017;10:1
Eyquem J, et al. Targeting a CAR to the TRAC locus with CRISPR/Cas9 enhances tumour rejection. Nature 2017;543(7643):113-117




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.