
- DAZ.online
- DAZ / AZ
- DAZ 21/2016
- Gezielt aus- oder ...
Arzneimittel und Therapie
Gezielt aus- oder anschalten
Die neuen Therapiemöglichkeiten beim schwarzen Hautkrebs
Zwei ganz unterschiedliche Strategien sind der Schlüssel für diesen bemerkenswerten Fortschritt: Zum einen erwies sich die Störung eines wichtigen Signaltransduktionswegs als sehr effektiv, das Tumorwachstum zu hemmen. Zum anderen wurde das Immunsystem für die Behandlung von Tumorerkrankungen neu entdeckt. Unter dem Sammelbegriff „Immun-Checkpoint-Inhibitoren“ stehen nun Wirkstoffe zur Verfügung, die Tumorzellen, die sich zuvor durch eine hinterhältige molekulare Strategie der Erkennung durch das Immunsystem entzogen hatten, wieder für den Angriff durch T-Zellen sichtbar machen. All diese innovativen Wirkstoffe führen zu einer deutlichen Steigerung der Überlebenszeit, und im Vergleich zu den Standardtherapien sind sie außerdem auch meist besser verträglich. Zudem ist ein Ende dieser positiven Entwicklung noch lange nicht erreicht. Mehrere innovative Wirkstoffe befinden sich derzeit in der klinischen Phase-III-Prüfung.
Signaltransduktions-Inhibitoren
Die konsequente Erforschung der molekularen Mechanismen, die Zellwachstum und Zelltod regulieren, beginnt momentan, massiv Früchte zu tragen für Behandlungsstrategien von Krankheiten, bei denen Zellteilung gegenüber einem natürlichen Zelltod derart die Überhand gewonnen hat, dass die betroffenen Patienten an dieser Fehlregulation zu sterben drohen. Diese fatale Fehlsteuerung resultiert aus Mutationen, die Schaltermoleküle in einen permanenten An-Zustand versetzen, so dass ständig Zellteilungssignale gegeben werden, woraus dann unkontrolliertes Wachstum resultiert.
Diese kurze Charakterisierung ist die funktionelle Beschreibung von Onkogenen, bei denen sich durch aktivierende Mutationen in den korrespondierenden Proto-Onkogenen pathologische Eigenschaften manifestieren. Die gute Seite dieser fatalen Erkenntnis ist, dass sich hier offensichtlich Optionen zur Intervention bieten, indem gezielt entwickelte Hemmstoffe die nicht mehr steuerbare Signalaktivität ausschalten. Gelingt es, die Produkte dieser Onkogene durch spezifische Medikamente zu hemmen, kann damit gerechnet werden, dass das unkontrollierte Wachstum der Zellen zum Stillstand kommt, da der molekulare Treiber des unkontrollierten Wachstums nun nicht mehr funktioniert.
Onkogenprodukte lassen sich in sechs Klassen einteilen:
- Wachstumsfaktoren
- Wachstumsfaktor-Rezeptoren
- Signaltransduktoren
- Transkriptionsfaktoren
- Chromatin-Remodeller
- Apoptose-Regulatoren
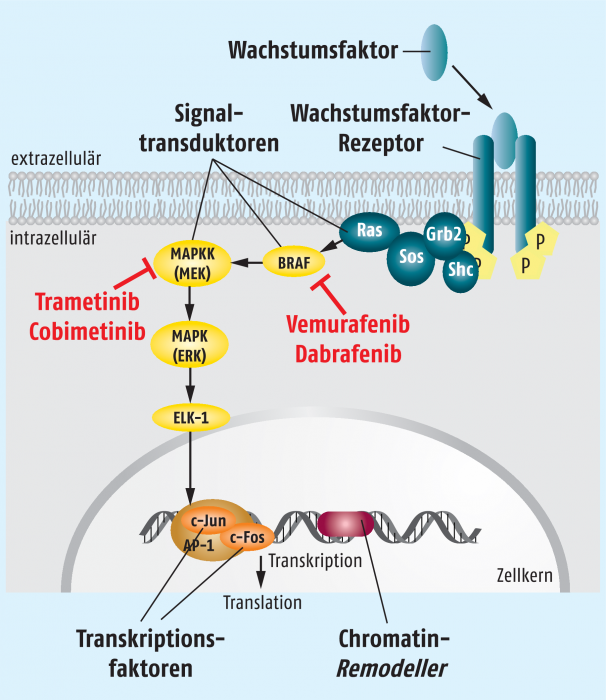
Eine sehr prominente Stellung unter den vielen Signaltransduktionswegen in einer Zelle besitzt der Mitogen-aktivierte-Proteinkinase-Weg (MAPK). Über diese Signalkette werden Zellwachstum, Zelldifferenzierung und Zellüberleben gesteuert. Es ist daher nicht verwunderlich, dass dieser Signalweg häufig bei Tumorarten gestört ist (siehe Abbildung 1).
Abb. 1: Der Mitogen-aktivierte-Proteinkinase-Wegist ein wichtiger Signalweg innerhalb der Zelle. Bei vielen Melanomzellen ist BRAF so mutiert, dass permanent Zellteilungssignale an den Zellkern weitergegeben werden. Deshalb ist BRAF eine interessante Zielstruktur für Tumormedikamente, ebenso wie das nachgeschaltete MEK.
Im Jahre 2002 konnte gezeigt werden, dass eine spezifische Mutation im BRAF-Gen das korrespondierende Protein in seiner Funktion so verändert, dass der Signalweg konstitutiv aktiviert ist, so dass ununterbrochen Zellteilungssignale in den Kern der Zelle gesendet werden. Diese teilen sich daraufhin permanent und entkommen dem natürlichen Zelltod (Apoptose).
Die wichtigste BRAF-Mutation führt zu einem Valin → Glutaminsäure-Austausch an der Position 600 (BRAF V600E) [1]. In fast 60% der kutanen Melanome lässt sich diese Mutation nachweisen. Die naheliegende Hypothese, dass das Wachstum eines Tumors mit einer derart konstitutiv aktivierten BRAF-Variante durch spezifische Inhibitoren gestoppt werden könnte, bestätigte sich eindrucksvoll in den klinischen Programmen zur Testung der BRAF-Inhibitoren Vemurafenib und Dabrafenib. Das klinische Outcome ließ sich dann noch einmal verbessern durch die Kombination der BRAF-Inhibitoren mit Trametinib, einem Hemmstoff für die nachgeschaltete MAP-Kinase-Kinase (MAPKK), die allgemein als MEK bezeichnet wird.
Mittlerweile gehört der Einsatz von BRAF-Inhibitoren, gegebenenfalls in Kombination mit einem MEK-Inhibitor, zur Standardtherapie bei der Behandlung eines kutanen Melanoms. Allerdings ist zuvor zwingend der BRAF-Mutationsstatus zu testen, da man davon ausgeht, dass das Tumorwachstum nur dann unter der primären Kontrolle des MAPK-Wegs steht, wenn das BRAF-Gen die aktivierende BRAF-V600E-Mutation trägt. Und nur dann ist ein Eingriff in diesen Signaltransduktionsweg gerechtfertigt.
Vemurafenib und Dabrafenib
Vemurafenib (Zelboraf®) war der erste BRAF-Inhibitor, der die oben geschilderte Hypothese bestätigte. In einer randomisierten Phase-III-Studie [2] wurde Vemurafenib gegen eine Chemotherapie mit Dacarbazin bei 675 zuvor unbehandelten Patienten getestet, bei denen ein metastasiertes, BRAF-V600E-positives Melanom diagnostiziert worden war. Die Gesamtüberlebensrate betrug für die Vemurafenib-Gruppe 48% und für die Dacarbazin-Gruppe 5%. Auch das mittlere progressionsfreie Überleben war bei den Patienten, die mit Vemurafenib behandelt wurden, deutlich länger (5,3 Monate) als bei den Patienten, die mit Dacarbazin behandelt wurden (1,6 Monate) (HR 0,26; CI 0,20 bis 0,33; p < 0,0001). Ähnlich bemerkenswerte Resultate wurden auch bei der Testung von Dabrafenib (Tafinlar®) erzielt (mittleres progressionsfreies Überleben 5,1 Monate für Dabrafenib vs. 2,7 Monate für Dacarbazin; HR 0,30: 95% CI 0,18 bis 0,51; p < 0,0001).
Trametinib und Kombinationen
Mit Trametinib (Mekinist®) wurde ein Inhibitor von MEK1/2, der dem BRAF nachgeschalteten Signalkomponente, entwickelt. Auch Trametinib erwies sich zur Behandlung BRAF-V600E-positiver Melanome als wirksam [3]. In der METRIC-Studie betrug das mittlere progressionsfreie Überleben für Patienten, die mit Trametinib behandelt wurden, 4,8 Monate im Vergleich zu 1,5 Monaten für Patienten, die mit einer Chemotherapie behandelt wurden. Nach sechs Monaten lag die Gesamtüberlebensrate im Trametinib-Arm bei 81% und im Chemotherapie-Arm bei 67%.
Ein weiterer MEK-Inhibitor ist Cobimetinib (Cotellic®), der in der Kombination mit Vemurafenib zur Behandlung bei erwachsenen Patienten mit nicht resezierbarem oder metastasiertem Melanom mit einer BRAF-V600E-Mutation zugelassen ist.
Diese Therapie eröffnet eine neue Entwicklung, denn die Beobachtungen, dass sich relativ schnell Resistenzen gegenüber den Wirkstoffen ausbilden, trüben die ansonsten guten Aussichten einer Behandlung mit Inhibitoren des MAPK-Weges. Die Ursachen dieser Resistenzbildung sind noch nicht abschließend verstanden. Eine Hypothese besagt, dass die Inhibitoren eine Heterodimerisierung mit BRAF-Wildtypformen fördern, die paradoxerweise den Signaltransduktionsweg reaktivieren [4 - 7]. Nun konnte in In-vitro-Studien gezeigt werden, dass die Kombination eines BRAF-Inhibitors mit einem MEK1/2-Inhibitor eine derartige Reaktivierung des MAPK-Weges hemmt, was wiederum zu einer stärkeren Hemmung der intrazellulären Signalgebung und geringeren Tumorzellproliferation führt. Zudem verringern derartige Kombinationen auch die Ausbildung bestimmter Sekundärtumoren, was zu den bedenklichsten unerwünschten Arzneimittelwirkungen von BRAF-Inhibitoren zählt.
In einer kürzlich durchgeführten Phase-III-Studie [8] wurde die Kombination von Dabrafenib und Trametinib mit einer Dabrafenib-Monotherapie verglichen. Das mediane progressionsfreie Überleben betrug im Kombinationsarm 9,3 Monate und im Monotherapie-Arm 8,8 Monate. Die relative Gesamtüberlebensrate lag bei 67% im Kombinationsarm und bei 51% im Monotherapie-Arm.
In einer anderen Phase-III-Studie [9] wurde eine Vemurafenib/Trametinib-Kombination untersucht. Hier zeigte sich ein medianes progressionsfreies Überleben im Kombinationsarm von 9,9 Monaten und im Monotherapie-Arm von 6,2 Monaten.
Immunotherapie
Verblüfft bereits die Erfolgsstory der Kinase-Inhibitoren, so erstaunt die zweite Erfolgsstory noch deutlich mehr. Das Melanom ist der Tumor, bei dem die Immuntherapie endlich ihr außergewöhnliches Potenzial beim Kampf gegen den Krebs beweisen konnte. Dabei kommen diese Erfolge bei Lichte betrachtet nicht so sehr überraschend. Denn seit Langem laufen Bemühungen, gerade dieses Krebsleiden mithilfe des Immunsystems zu bekämpfen. Eine Hochdosis-Interleukin-2-Therapie wurde bereits im Jahre 1998 in den USA zur Behandlung des Melanoms zugelassen, obwohl bei dieser Therapie Nebenwirkungen in Kauf genommen werden mussten, die nur schwer tolerierbar waren [10]. Das Ziel der Intervention waren hier T-Zellen, denn Interleukin 2 (IL-2) ist einer der wichtigsten Stimulatoren für die T-Zell-Proliferation und -Differenzierung. Obwohl diese Therapie nie in kontrollierten Phase-III-Studien getestet worden war, wurden immer wieder nachhaltige Erfolge beschrieben. In Europa hat diese Therapie keine Zulassung erhalten.
Die T-Zelle, eine leider oft stumpfe Waffe bei der Tumor-Abwehr mit dem Potenzial zur Aktivierung
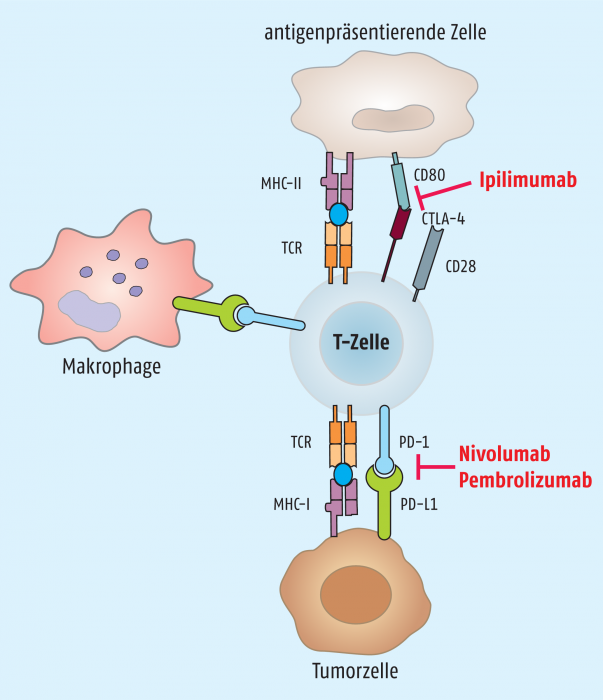
T-Zellen spielen eine zentrale Rolle bei der Vermittlung einer zellulären Immunität und der Tumor-Immuntherapie. Der klassische Aktivierungsmechanismus dieser scharfen Waffe benötigt zwei unabhängige Signale (siehe Abbildung 2). Zum einen ist eine Interaktion des T-Zellrezeptors (TCR) mit dem durch ein MHC-I-Molekül präsentiertes Antigen erforderlich. Ferner muss ein zweites, kostimulierendes Signal vorhanden sein, das durch die Interaktion von CD28 auf der T-Zell-Oberfläche mit dem B7-1-Protein (CD80) auf der antigenpräsentierenden Zelle (APC) zustande kommt [11]. Erst wenn sich beide Interaktionspaare gefunden haben, erfolgt die Aktivierung.
Abb. 2: Zur Aktivierung brauchen T-Zellen zusätzlich zur Interaktion zwischen T-Zellrezeptor und MHC-Molekül ein zweites Signal aus der Interaktion zwischen CD80 und CD28. Diese Aktivierung kann wieder abgeschaltet werden, wenn CTLA-4 an CD80 bindet. Ipilimumab verhindert die Inaktivierung der T-Zelle. Einen ähnlichen Effekt, nur über andere Oberflächenmoleküle, haben die Antikörper Nivolumab bzw. Pembrolizumab.
Wie immer bei so wichtigen Kontrollmechanismen gibt es hier auch Abschaltoptionen. Dabei kommen zwei koinhibierende Rezeptoren ins Spiel, die auch als Immun-Checkpoints bezeichnet werden. Dies sind die T-Zell-Oberflächenproteine CTLA-4 (cytotoxic T-lymphocyte-associated protein 4) und PD-1 (programmed cell death protein 1). Diese Oberflächenproteine verhindern eine T-Zell-Überaktivierung, sie fördern Toleranz und tragen so unter anderem zur Vermeidung einer Autoimmunität bei [12].
CTLA-4 wird natürlicherweise ca. 48 Stunden nach einer T-Zell-Aktivierung durch die T-Zelle exprimiert. Sobald das Protein auf der T-Zell-Oberfläche erscheint, bindet es an den B7-1-Rezeptor (CD80) auf der antigenpräsentierenden Zelle und verdrängt den aktivierenden Liganden CD28, da CTLA-4 eine größere Affinität zu CD80 als zu CD28 besitzt [13].
Ein zweiter T-Zell-inaktivierender Prozess setzt ein, wenn aktivierte T-Zellen in ein Gebiet einwandern, das von einem Tumor kontrolliert wird. Sie werden dort von den Tumorzellen dahingehend getäuscht, dass sie eine Toleranz gegenüber dem Tumor entwickeln, was fatalerweise gleichbedeutend ist mit einer funktionellen Inaktivität. Ursache für diesen Täuschungsmechanismus ist die Interaktion des sogenannten PD-1-Liganden (PD-1L) mit dem PD-1-Rezeptor auf der T-Zell-Oberfläche. Dabei wird der PD-1-Ligand von der Tumorzelle synthetisiert, ein äußerst effizientes Abwehrmanöver als Schutz vor einem T-Zell-Angriff [14].
Beide geschilderten Strategien zur T-Zell-Inaktivierung lassen sich offensichtlich stören, und dieses Konzept wurde realisiert durch die Entwicklung der Immun-Checkpoint-Inhibitoren, von denen derzeit Ipilimumab als CTLA-4-Blocker und Pembrolizumab und Nivolumab als PD-1-/PD-1L-Blocker zur Therapie eines fortgeschrittenen Melanoms zugelassen sind.
Der CTLA-4-Antikörper Ipilimumab
Ipilimumab (Yervoy®) ist ein humaner IgG1-Antikörper, der an CTLA-4 bindet und dieses hemmende Signal der T-Zell-Aktivierung ausschaltet. Dieser Antikörper wurde klinisch erfolgreich sowohl bei vorbehandelten (MDX010-20-Studie) als auch bei unbehandelten Patienten (CA184-024-Studie) mit fortgeschrittenem Melanom getestet, worauf sowohl die EMA als auch die FDA im Jahre 2011 die Zulassung erteilten.
In der MDX010-20-Studie [15], in der 676 Patienten mit einem nicht-operablen Melanom (Stadium III oder IV) eingeschlossen waren, erwies sich Ipilimumab einer Immuntherapie mit einer Peptid-Vakzine deutlich überlegen. Das Gesamtüberleben betrug zehn Monate für die Patienten im Ipilimumab-Arm und 6,4 Monate für die Patienten im Kontroll-Arm. Das Ein- bzw. Zwei-Jahres-Überleben betrug im Ipilimumab-Arm 45,6% bzw. 23,5% und 23,5% bzw. 13,7% im Kontroll-Arm.
Diese positiven Ergebnisse konnten in der CA184-024-Studie [16] bestätigt werden, in die unbehandelte Patienten mit einem metastasierenden Melanom eingeschlossen wurden. Insgesamt nahmen 502 Patienten an der Studie teil, die entweder mit Ipilimumab plus Dacarbazin oder mit Placebo plus Dacarbazin behandelt wurden. Für die Ipilimumab/Dacarbazin-Gruppe wurde ein Gesamtüberleben von 11,2 Monaten gegenüber 9,1 Monaten für die Kontroll-Gruppe beobachtet. Auch die Ein-, Zwei- oder Drei-Jahres-Überlebensraten waren mit 47,3%, 28,5% und 20,8% in der Ipilimumab/Dacarbazin-Gruppe deutlich höher als in der Kontroll-Gruppe (36,3%, 17,9% und 12,2%). Weitere Studien bestätigten diese positiven Ergebnisse [17 – 19].
Trotz dieser sehr positiven Ergebnisse bleiben Fragen. Denn das Ansprechen auf eine Therapie mit Ipilimumab ist sehr variabel und derzeit nicht kalkulierbar. Bei einer kleinen Zahl von Patienten beobachtet man eine komplette Remission, während andere transient oder gar nicht ansprechen. Es wird daher derzeit intensiv nach Biomarkern gesucht, die eine gewisse Prognose ermöglichen. Zusätzlich beobachtet man ein Phänomen, das die Therapeuten vor schwierige Entscheidungen stellt. Bei Patienten, die mit Ipilimumab behandelt werden, steigt zunächst die Tumormasse im Vergleich zu Patienten, die mit konventioneller Chemotherapie behandelt werden. Erst allmählich verkleinert sich der Tumor. Diese Besonderheit schränkt den Einsatz des Antikörpers bei Patienten mit einer großen Tumorlast deutlich ein.
Der schwarze Hautkrebs
Das Maligne Melanom ist nicht die häufigste Hautkrebsart, aber die bekannteste. Es ist in Deutschland für ca. 1% der Krebstodesfälle verantwortlich und ist keine Alterserkrankung: Bereits bei jüngeren Personen wird der pigmentierte Hauttumor in großer Zahl entdeckt. Er entwickelt sich aus Melanozyten, den pigmentbildenden Zellen der Haut. Als wichtigster endogener Risikofaktor für die Entstehung gilt die Anzahl an Pigmentmalen bei einem Menschen. Als wichtigster exogener Faktor wird eine zeitweilig stark erhöhte Exposition natürlicher oder künstlicher UV-Strahlung angesehen.
Quelle: Krebs in Deutschland 2011/2012, Beiträge zur Gesundheitsberichterstattung des Bundes, 10. Ausgabe, 2015
Die PD-1/PD-L1-Antikörper Pembrolizumab und Nivolumab
Die PD-1/PD-L-Antikörper zählen heute zu den Immun-Checkpoint-Inhibitoren der zweiten Generation, deren Entwicklung deutlich durch die Erfahrungen profitiert hat, die mit Ipilimumab gemacht wurden.
Pembrolizumab (Keytruda®) ist ein hoch-selektiver, humanisierter monoklonaler IgG4-Antikörper gegen den PD-1-Liganden (PD-L1), mit dem ein anhaltendes, objektives Ansprechen bei Patienten mit metastasierendem Melanom erreicht wird [20]. Dieser Antikörper wurde von der FDA beschleunigt zugelassen, da eine Phase-I-Studie eine sehr gute Anti-Tumoraktivität und ein akzeptables Sicherheitsprofil hatte erkennen lassen [21]. Eingeschlossen in die Studien wurden vor allem Patienten, die nicht mehr auf Ipilimumab ansprachen. In einer kürzlich publizierten Phase-III-Studie (KEYNOTE-006) wurde dann auch Pembrolizumab mit Ipilimumab bei Patienten mit einem fortgeschrittenen Melanom verglichen [20]. Dabei zeigte Pembrolizumab verglichen mit Ipilimumab ein längeres progressionsfreies Überleben (47,3% vs. 26,5%), eine längere Ein-Jahres-Überlebensrate (74,1% vs. 58,2%) und weniger schwere Nebenwirkungen (13,3% vs. 19,9%).
Der zweite Antikörper aus dieser Gruppe ist Nivolumab (Opdivo®). Dieser humane IgG4-Antikörper ist ein PD-1-Inhibitor. In einer Phase-III-Studie (CheckMate-037) wurde er an Patienten mit fortgeschrittenem Melanom getestet, die auf Ipilimumab nicht mehr ansprachen. Ansprechraten von 31,7% vs. 10,6% in der Kontroll-Gruppe wurden beobachtet. Außerdem wurde die Therapie besser vertragen (5% vs. 9% schwere Nebenwirkungen) [22]. In einer Phase-III-Studie, in der Nivolumab gegen Dacarbazin getestet wurde, war die Ein-Jahres-Überlebensrate bei zuvor unbehandelten Patienten ohne BRAF-Mutation in der Nivolumab-Gruppe 72,9% vs. 42,1% in der Dacarbazin-Gruppe [23].
Kombinationstherapie mit Immun-Checkpoint-Inhibitoren
Da CTLA-4- und PD-1-/PD-1L-Antikörper komplementäre Funktionssysteme adressieren, liegt es nahe, diese beiden Therapieprinzipien zu kombinieren. Während CTLA-4 seine Wirkung in der frühen Phase der T-Zell-Aktivierung entfaltet, fungiert PD-1 als Schalter zur T-Zell-Aktivierung in der Gewebeperipherie im Rahmen der Effektorphase.
Etliche Studien deuten darauf hin, dass das Konzept einer Kombinationstherapie aufgehen könnte. In einer Phase-III-Studie (CheckMate-067) wurde Nivolumab in Kombination mit Ipilimumab an Patienten mit bisher unbehandeltem Melanom gegen die jeweiligen Monotherapien mit beachtlichem Erfolg getestet. Das progressionsfreie Überleben betrug 11,5 Monate mit der Kombinationstherapie gegenüber 2,9 Monaten mit der Ipilimumab-Therapie bzw. 6,9 Monate mit der Nivolumab-Therapie (Larkin et al. 2015). Auch die Gesamt-Ansprechrate war mit 57,6% bei den Patienten, die mit der Kombination behandelt wurden, deutlich besser als bei den Patienten, die nur mit Nivolumab (43,7%) oder Ipilimumab (19%) behandelt wurden. Allerdings wurden unter der Kombination auch mehr Nebenwirkungen beobachtet.
Unerwünschte Wirkungen bei einer Therapie mit Immun-Checkpoint-Inhibitoren
Eine störende Überraschung bescherte die neue Immuntherapie in Form neuer, in dieser Form noch nicht beobachteter Nebenwirkungen. Diese werden heute als immune-related adverse events (irAE) bezeichnet, und sie könnten die so vielversprechende Immuntherapie deutlich verkomplizieren. Hierbei handelt es sich hauptsächlich um Entzündungsreaktionen in Off-target-Organsystemen. Sie äußern sich als Dermatitis, Hepatitis, Colitis und Hypophysitis [24]. So entwickeln nahezu 50% der Patienten, die mit Ipilimumab behandelt werden, Hautirritationen, die gelegentlich auch schwer ausfallen können. Glücklicherweise verlaufen die meisten immune-related adverse events milde und transient, manchmal allerdings auch schwer und tödlich.
Wichtig ist es, diese immunvermittelten Nebenwirkungen schnell und zuverlässig zu erkennen und geeignete Maßnahmen zur Kontrolle der Reaktionen einzuleiten. Dazu gehört beispielsweise der kurzfristige Einsatz von Immunsuppressiva, die in der Regel nicht die Effizienz der Behandlung stören. Meist werden Corticosteroide verwendet. Sollte dies nicht erfolgreich sein, kann auch ein Einsatz von Infliximab in Erwägung gezogen werden.
Alle Patienten, die wegen einer Autoimmunerkrankung und infolge einer Organtransplantation dauerhaft immunsupprimiert sind, kommen nicht in den Genuss einer Therapie mit Immun-Checkpoint-Inhibitoren. In ihrem Fall wäre die Stimulierung der T-Zellen zu gefährlich für das Fremdorgan oder die Autoimmunerkrankung.
Neue Ansätze in Richtung Tumor-Immuntherapie
Die Tumortherapie hat durch die Erfolge, die sich mit den Signaltransduktions-Inhibitoren und den Immun-Checkpoint-Inhibitoren eingestellt haben, „frischen Wind“ bekommen. Da ist es nicht verwunderlich, dass an Strategien gearbeitet wird, die bisher kaum einer auf dem Schirm hatte. Zu diesen zählen unter anderem die adaptive T-Zell-Transfertherapie, die T-Zell-Therapie mit chimären Antigenrezeptoren (CARs), die Therapie mit onkolytischen Viren und die therapeutische Vakzinierung.
Bei der adaptiven T-Zell-Transfertherapie werden teilungsfähige, gegen Tumorzellen gerichtete T-Lymphozyten dem Krebspatienten infundiert, wo sie eine langanhaltende Wirkung entfalten können. Die T-Zellen der Wahl sind entweder tumorinfiltrierende Lymphozyten (TIL) oder T-Lymphozyten des Patienten, die gentechnisch derart modifiziert wurden, dass sie T-Zell-Rezeptoren exprimieren, die spezielle Tumor-Antigene erkennen. Dieses Konzept wurde bereits in mehreren Studien bei etlichen Patienten mit einem fortgeschrittenen Melanom erprobt, wobei bemerkenswerte Erfolge beobachtet wurden. So zeigten bis zu 40% der Patienten eine Totalremission, die teils bis zu sieben Jahre anhielt [25, 26].
Demgegenüber handelt es sich bei der T-Zell-Therapie mit chimären Antigenrezeptoren (CARs) um eine Gentherapie. Chimäre Antigenrezeptoren sind Fusionsproteine, die eine Antigen-Erkennungsdomäne eines Antikörpers sowie eine signalisierende Region der sogenannten CD3-ζ-Domäne besitzen. Die Gene, die diese chimären Antigenrezeptoren kodieren, können durch unterschiedliche Transfer-Techniken eingeführt werden [27]. Verglichen mit ihren natürlichen Vorbildern besitzen die T-Zellen, die einen CAR exprimieren, die Eigenschaft, MHC-unabhängig tumorassoziierte Antigene zu erkennen. Dadurch umgeht man eine der Haupt-Ausweichstrategien zur Immunerkennung, die Tumorzellen mit der Zeit entwickeln, wenn sie die Expression der MHC-Proteine herunterregulieren. Das Prinzip wurde bereits mehrfach verbessert, und deutliche Erfolge bei der Behandlung von hämatologischen Tumoren haben das Prinzip bestätigen können [28 – 30]. Allerdings wird es hier sicher noch einige Zeit dauern, bis dieses Prinzip weitreichend Einzug in die Klinik erhält.
Ein weiterer experimenteller Ansatz in der Tumortherapie setzt onkolytische Viren ein, die so manipuliert sind, dass sie nur in Tumorzellen replizieren können und diese Wirtszellen dabei zerstören (Onkolyse). Ein Kandidat dieser onkolytischen Viren firmiert unter dem Namen Talimogene laherparepvec (T-VEC, Imlygic®). Hierbei handelt es sich um eine Variante des Herpesvirus Typ 1, die direkt in ein Melanom injiziert wird. In den Zellen repliziert das Virus und synthetisiert zudem GM-CSF-Moleküle. Lysieren die Viren die Tumorzelle, werden einerseits Antigene freigesetzt, die von dieser Tumorzelle stammen. Außerdem triggert GM-CSF eine systemische Immunantwort, durch die der Tumor attackiert wird. In einer jüngeren Phase-III-Studie (OPTiM) zeigte die Therapie mit onkolytischen Viren bei Patienten mit fortgeschrittenem Melanom eine deutliche Überlegenheit gegenüber einer Behandlung mit subkutan appliziertem GM-CSF [31]. Auf Basis dieser Studie wurde im Oktober 2015 T-VEC von der FDA als erste Therapie mit onkolytischen Viren zugelassen.
Die therapeutische Vakzinierung zielt darauf ab, das Immunsystem des Patienten gezielt für die Bekämpfung des Tumors zu aktivieren [32]. Etliche Ansätze für dieses sehr plausible Konzept wurden hier verfolgt, wobei tumorspezifische Antigene entweder als synthetisch hergestellte Peptide mit Adjuvans oder als Tumorzelllysat verabreicht wurden. Alternativ wurden autologe dendritische Zellen isoliert, die ex vivo mit den Tumorantigenen stimuliert und anschließend dem Patienten wieder infundiert wurden. Jedoch haben sich überzeugende Erfolge bisher nicht eingestellt [33]. Allerdings wurde auch noch nicht resigniert. In mehreren klinischen Studien wird das Potenzial einer therapeutischen Vakzinierung weiter ausgelotet.
Resümee
Die Behandlungsoptionen für fortgeschrittene Melanom-Erkrankungen erweitern sich mit einer erstaunlichen Geschwindigkeit. Manch einer spricht von einer „goldenen Phase der Tumortherapie“, die sich mit Sicherheit nicht auf den schwarzen Hautkrebs beschränken wird, auch z. B. bei nicht-kleinzelligem Lungenkarzinom gibt es interessante neue Therapieoptionen. Neue Hypothesen haben ihre Validität bewiesen und schnell zu neuen Medikamenten geführt. Dabei ist der Trend zur personalisierten Behandlung eines Tumors mit bestimmten Eigenschaften unverkennbar. |
Literatur
[1] Wellbrock C, Karasarides M, Marais, R. The RAF proteins take centre stage. Nat Rev Mol Cell Biol 2004;5:875–885
[2] Chapman PB, Hauschild A, Robert C, Haanen JB, Ascierto P, Larkin J et al. Improved survival with vemurafenib in melanoma with BRAF V600E mutation. N Engl J Med 2011;364:2507–2516
[3] Flaherty KT, Robert C, Hersey P, Nathan P, Garbe, C Milhem M et al. Improved survival with MEK inhibition in BRAF-mutated melanoma. N Engl J Med 2012a;367:107–114
[4] Sullivan RJ, Flaherty KT. Resistance to BRAF-targeted therapy in melanoma. Eur J Cancer 2013;49:1297–1304
[5] Emery CM, Vijayendran KG, Zipser MC, Sawyer AM, Niu L, Kim JJ et al. MEK1 mutations confer resistance to MEK and B-RAF inhibition. Proc Natl Acad Sci USA 2009;106:20411–20416
[6] Nazarian R, Shi H, Wang Q, Kong X, Koya RC, Lee H et al. Melanomas acquire resistance to B-RAF(V600E) inhibition by RTK or N-RAS upregulation. Nature 2010;468:973–977
[7] Nathanson KL, Martin AM, Wubbenhorst B, Greshock J, Letrero R, D’Andrea K et al. Tumor genetic analyses of patients with metastatic melanoma treated with the BRAF inhibitor dabrafenib (GSK2118436). Clin Cancer Res 2013;19:4868–4878
[8] Long GV, Stroyakovskiy D, Gogas H, Levchenko E, de Braud F, Larkin J et al. Combined BRAF and MEK inhibition versus BRAF inhibition alone in melanoma. N Engl J Med 2014;371:1877–1888
[9] Larkin J, Ascierto PA, Dreno B, Atkinson V, Liszkay G, Maio M et al. Combined vemurafenib and cobimetinib in BRAF-mutated melanoma. N Engl J Med 2014;371;1867–1876
[10] Kammula US, White DE, Rosenberg SA. Trends in the safety of high dose bolus interleukin-2 administration in patients with metastatic cancer. Cancer 1998;83:797–805
[11] Chen L, Flies DB. Molecular mechanisms of T cell co-stimulation and co-inhibition. Nat Rev Immunol 2013;13:227–242
[12] Freeman GJ, Long AJ, Iwai Y, Bourque K, Chernova T, Nishimura H et al. Engagement of the PD-1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte activation. J Exp Med 2000;192:1027–1034
[13] Walunas TL, Lenschow DJ, Bakker CY, Linsley PS, Freeman GJ, Green JM et al. CTLA-4 can function as a negative regulator of T cell activation. Immunity 1994;1:405–413
[14] Blank C, Brown I, Peterson AC, Spiotto M, Iwai Y, Honjo T et al. PD-L1/B7H-1 inhibits the effector phase of tumor rejection by T cell receptor (TCR) transgenic CD8+ T cells. Cancer Res 2004;64:1140–1145
[15] Hodi FS, O’Day SJ, McDermott DF, Weber RW, Sosman JA, Haanen JB et al. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med 2010;363:711–723
[16] Robert C, Thomas L, Bondarenko I, O’Day S, Weber J, Garbe C et al. Ipilimumab plus dacarbazine for previously untreated metastatic melanoma. N Engl J Med 2011;364:2517–2526
[17] Maio M, Grob JJ, Aamdal S, Bondarenko I, Robert C, Thomas L et al. Five-year survival rates for treatment-naive patients with advanced melanoma who received ipilimumab plus dacarbazine in a phase III trial. J Clin Oncol 2015;33:1191–1196
[18] Eggermont AM, Chiarion-Sileni V, Grob JJ, Dummer R, Wolchok JD, Schmidt H et al. Adjuvant ipilimumab versus placebo after complete resection of high-risk stage III melanoma (EORTC 18071): a randomised, double-blind, phase 3 trial. Lancet Oncol 2015;16(5):522–530
[19] Schadendorf D, Hodi FS, Robert C, Weber JS, Margolin K, Hamid O et al. Pooled analysis of long-term survival data from phase II and phase III trials of ipilimumab in unresectable or metastatic melanoma. J Clin Oncol 2015;33(17):1889–1894
[20] Robert C, Schachter J, Long GV, Arance A, Grob JJ, Mortier L et al. Pembrolizumab versus ipilimumab in advanced melanoma. N Engl J Med 2015;372(26): 2521–2532
[21] Robert C, Ribas A, Wolchok JD, Hodi FS, Hamid O, Kefford R et al. Anti-programmed-death-receptor-1 treatment with pembrolizumab inipilimumab-refractory advanced melanoma: a randomised dose-comparison cohort of a phase 1 trial. Lancet 2014;384:1109–1117
[22] Weber JS, D’Angelo SP, Minor D, Hodi FS, Gutzmer R, Neyns B et al. Nivolumab versus chemotherapy in patients with advanced melanoma who progressed after anti-CTLA-4 treatment (CheckMate 037): a randomised, controlled, open-label, phase 3 trial. Lancet Oncol 2015;16:375–384
[23] Robert C, Long GV, Brady B, Dutriaux C, Maio M, Mortier L et al. Nivolumab in previously untreated melanoma without BRAF mutation. N Engl J Med 2015;372:320–330
[24] Postow MA. Managing immune checkpoint-blocking antibody side effects. Am Soc Clin Oncol Educ Book 2015;35:76–83
[25] Rosenberg SA, Yang JC, Sherry RM, Kammula US, Hughes, MS, Phan GQ et al. Durable complete responses in heavily pretreated patients with metastatic melanoma using T-cell transfer immunotherapy. Clin. Cancer Res 2011;17:4550–4557
[26] Phan GQ, Rosenberg SA. Adoptive cell transfer for patients with metastatic melanoma: the potential and promise of cancer immunotherapy. Cancer Control 2013;20:289–297
[27] Barrett DM, Singh N, Porter DL, Grupp SA, June CH. Chimeric antigen receptor therapy for cancer. Annu Rev Med 2014;65:333–347
[28] Garfall AL, Maus MV, Hwang WT, Lacey SF, Mahnke YD, Melenhorst JJ et al. Chimeric antigen receptor T cells against CD19 for multiple myeloma. N Engl J Med 2015;373:1040–1047
[29] Lee DW, Kochenderfer JN, Stetler-Stevenson M, Cui YK, Delbrook C, Feldman SA et al. T cells expressing CD19 chimeric antigen receptors for acute lymphoblastic leukaemia in children and young adults: a phase 1 dose-escalation trial. Lancet 2015;385:517–528
[30] Kochenderfer JN, Dudley ME, Kassim SH, Somerville RP, Carpenter RO, Stetler-Stevenson M et al. Chemotherapy-refractory diffuse large B-cell lymphoma and indolent B-cell malignancies can be effectively treated with autologous T cells expressing an anti-CD19 chimeric antigen receptor. J Clin Oncol 2015;33:540–549
[31] Andtbacka RH, Kaufman HL, Collichio F, Amatruda T, Senzer N, Chesney J et al. Talimogene laherparepvec improves durable response rate in patients with advanced melanoma. J Clin Oncol 2015;33:2780–2788
[32] Melero I, Gaudernack G, Gerritsen W, Huber C, Parmiani G, Scholl S et al. Therapeutic vaccines for cancer: an overview of clinical trials. Nat Rev Clin Oncol 2014;11:509–524
[33] Blanchard T, Srivastava PK, Duan F. Vaccines against advanced melanoma. Clin Dermatol 2013;31:179–190

























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.