
- DAZ.online
- DAZ / AZ
- DAZ 21/2016
- Cranberry-Früchte gegen ...
Phytoforschung
Cranberry-Früchte gegen Blasenentzündung
Verhinderung der Adhäsion von E. coli an das Epithel der unteren Harnwege
Harnwegsinfektionen werden als unkompliziert bewertet, wenn keine relevanten Nierenfunktionsstörungen, Begleiterkrankungen, funktionellen oder anatomischen Anomalien im Harntrakt vorliegen, welche Harnwegsinfektionen oder gravierende Komplikationen begünstigen. Eine untere Harnwegsinfektion (Cystitis, Urethritis) wird angenommen, wenn sich die akuten Symptome auf den unteren Harntrakt beschränken, z. B. neu auftretende Schmerzen beim Wasserlassen (Dysurie), imperativer Harndrang, häufiges Wasserlassen kleiner Mengen (Pollakisurie) oder Schmerzen oberhalb der Schambeinfuge (Symphyse). Bei einer oberen Harnwegsinfektion (Pyelonephritis) stellt sich zusätzlich zu den akuten Symptomen z. B. Flankenschmerz, ein klopfschmerzhaftes Nierenlager und/oder Fieber > 38 °C ein [1]. Von rezidivierenden Harnwegsinfektionen spricht man, wenn mindestens zwei symptomatische Episoden pro Halbjahr oder mindestens drei Ereignisse pro Jahr auftreten [1].
Cranberries (d. h. Kranichbeeren) sind die Beerenfrüchte der Großfrüchtigen Moosbeere (Vaccinium macrocarpon) aus der Familie der Ericaceae (Abb. 1 und 2).
Abb. 1: Großfrüchtige Moosbeere (Vaccinium macrocarpon). Die aus den Blüten heraushängenden Staubfäden erinnern an einen Kranichschnabel, daher der Name Kranichbeere (engl. crane = Kranich).
Die Art ist in Nordamerika heimisch, wo der heutige Anbau schwerpunktmäßig in den nördlichen USA und Kanada stattfindet. Die Cranberry wird häufiger auch mit der bei uns einheimischen Preiselbeere (Vaccinium vitis-idaea) verglichen, die allerdings botanisch, geschmacklich und in Bezug auf die Inhaltsstoffe klar von der Großfrüchtigen Moosbeere abzugrenzen ist.
Abb. 2: Die Beerenfrüchte von V. macrocarponbesitzen vier Luftkammern, die bewirken, dass sie auf dem Wasser schwimmen.
Cranberries enthalten etwa zehn Prozent Kohlenhydrate, ein komplexes Spektrum an Flavonoiden, oligomeren Proanthocyanidinen (OPCs), Triterpenoiden und organischen Säuren sowie nennenswerte Mengen an Vitamin C.
Die Ergebnisse klinischer Untersuchungen von Cranberry-Zubereitungen zur Prävention von UTI sind Bestandteile eines systematischen Cochrane-Reviews, der erstmals 1998 publiziert wurde und mittlerweile drei Updates (2004, 2008, 2012) erfahren hat, was zum einen die Vielzahl an Studien belegt, aber auch das hohe öffentliche Interesse an der Anwendung von Cranberry-Zubereitungen. Während in den ursprünglichen Metaanalysen aus den Jahren 1998 und 2004 die klinische Evidenz von Cranberry-Zubereitungen durchaus positiv bewertet wurde, führte der Einschluss weiterer Studien in den Reviews von 2008 und 2012 zu einer deutlichen Abschwächung der Bewertung und damit auch der zurzeit vorliegenden Evidenz.
Die Problematik in der aktuellen Bewertungslage der vorliegenden „klinischen“ Untersuchungen von Cranberries hat allerdings sehr grundlegende Ursachen: Viele der Studien berichten über eine geringe Compliance der Probanden, hohe Abbruchquoten wegen nicht akzeptierter Geschmackssensationen von Cranberry-Säften sowie auch den Einsatz von nicht-standardisierten Produkten in Form fester oraler Darreichungsformen, für die eindeutige quantitative Inhaltsstoffangaben nicht verfügbar sind.
Aus den Daten solcher „Studien“ ziehen die Autoren des aktuellen Cochrane-Reviews die Schlussfolgerung, dass Cranberry-Säfte zwar die Anzahl symptomatischer UTIs, insbesondere bei Frauen über einen zwölfmonatigen Beobachtungszeitraum, senken könnten; doch seien die Ergebnisse bei Einschluss aller, auch großer Studienkollektive, aus den o. g. Gründen nicht signifikant. Cranberry-Zubereitungen erwiesen sich aber auch als nicht signifikant unterschiedlich (weder positiv noch negativ!) zu einer antibiotischen Prophylaxe! Die Autoren meinen, dass der langfristige Einsatz von Cranberry-Säften zur Prophylaxe von UTI nicht empfohlen werden kann, allerdings nicht wegen fehlender Wirksamkeit, sondern weil sie aufgrund der geringen Compliance nicht langfristig eingenommen werden. Die Autoren sehen deswegen erfolgsversprechende Perspektiven in der Anwendung optimierter Darreichungsformen (Kapseln, Tabletten o. ä.), die allerdings auf einen definierten Gehalt standardisiert sein müssten.
Diese Kritik legt den Finger in die Wunde der aktuellen Cranberry-Anwendungen, nämlich dass keine zugelassenen Cranberry-Arzneimittel existent sind, sondern allenfalls Nahrungsergänzungsmittel, bei denen eindeutige qualitative und quantitative Angaben zu den Inhaltsstoffen meistens fehlen. Offensichtlich ist es notwendig, dass sich die pharmazeutische Industrie aktiv an die Entwicklung qualitativ hochwertiger Cranberry-Produkte im Pharmabereich wagt und ihre Zulassung als Arzneimittel beantragt – dies sollte, gerade aus Sicht der Apotheke, ein wichtiges künftiges Ziel werden.
Wie wirkt Cranberry?
Wie erklärt man sich nun die positiven Effekte von Cranberry bei UTI? Die Infektion wird überwiegend durch uropathogene E. coli (UPEC) ausgelöst. Direkte zytotoxische Effekte von Cranberry gegenüber UPEC (wie z. B. bei Arbutin-haltigen Zubereitungen aus Bärentraubenblättern) können ausgeschlossen werden. Allerdings zeigen verschiedene In-vitro-Untersuchungen, dass Cranberry-Extrakte die spezifische Adhäsion von UPEC an die Blasenzelle unterbinden. Für diese antiadhäsive Wirkung wurden in einer 2000 publizierten Studie [2] trimere A-Typ-Proanthocyanidine verantwortlich gemacht, die die Interaktion sogenannter P-Fimbrien von UPEC mit den komplementären Kohlenhydratliganden auf Zellen des Harnblasenepithels unterbinden. Diese Studie beeinflusste die Denkweise zu Cranberry lange Zeit ganz entscheidend, da man nun davon ausging, dass die OPCs für die antiadhäsive Wirkung von Cranberry verantwortlich sind. Noch heute finden sich in einigen Cranberry-Produktinformationen Angaben zum Vorliegen der angeblich wirksamen Proanthocyanidine.
Neuere Untersuchungen lassen Zweifel an diesen Aussagen zu, da mittlerweile allgemein akzeptiert ist, dass die systemische Bioverfügbarkeit von oral aufgenommenen Proanthocyanidinen (PACs) extrem gering ist und gerade bei OPCs deutlich unter zwei Prozent liegt. Sie werden durch die Fäkalflora im Dickdarm abgebaut und umgewandelt, wobei unklar ist, ob die Metaboliten z. T. resorbiert und systemisch verfügbar sind. Trotzdem ist eher davon auszugehen, dass Cranberry-Zubereitungen den postulierten antiadhäsiven Effekt nicht aufgrund des OPC-Gehaltes bewirken.
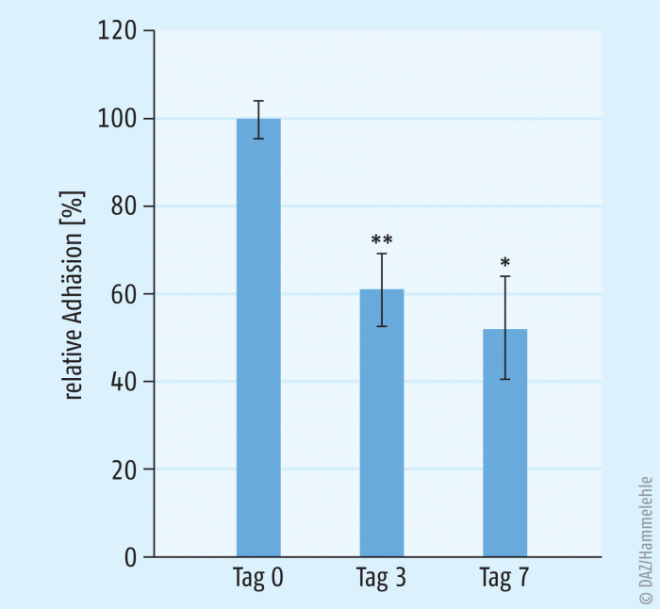
Eine kürzlich publizierte kombinierte In-vitro-/In-vivo-Pilotstudie zeigt auch in diesem Zusammenhang spannende neue Erkenntnisse [3]: Von vier Probanden, die sieben Tage lang einen standardisierten und mittels LC-MS/MS gut charakterisierten Cranberry-Trockenextrakt (Extract High PAC, Extraktionsmittel Wasser; Frutarom, Belgien) einnahmen, wurde der Urin gesammelt, der in einem standardisierten und validierten In-vitro-Adhäsionsassay hinsichtlich antiadhäsiver Eigenschaften gegenüber UPEC geprüft wurde. Tatsächlich ergaben sich aus Urinproben, die an den Tagen 3 und 7 des Einnahmezyklus genommen worden waren, signifikante antiadhäsive Effekte gegenüber UPEC, die im Bereich von 40 bis 50 Prozent Inhibition der bakteriellen Adhäsion an Blasenzellen lagen (Abb. 3). Dies zeigt klar, dass es sich bei Cranberry um eine Droge mit antiadhäsivem Potenzial handelt. Selbstverständlich muss dieser Pilotversuch mit einer größeren Stichprobenzahl reproduziert werden; eine entsprechende Interventionsstudie läuft zurzeit an der Universität Münster.
Abb. 3: Einfluss des Urins von vier Probanden, die sieben Tage lang täglich einen standardisierten Cranberry-Trockenextrakt einnahmen (Dosis 600 mg), auf die Adhäsion von UPEC (uropathogene E. coli, Stamm NU14) an T24-Blasenzellen (in vitro). Der initiale durchschnittliche Adhäsionswert am Tag 0 wurde als Index (100%) gewählt. Senkrechte Striche: Bereich der gemessenen Werte; * p < 0,05; ** p < 0,01. Aus [3].
Auch die Frage nach der antiadhäsiven Wirkung der PACs wurde untersucht: PACs lassen sich sehr einfach aus Extrakten mithilfe von Polyvinylpyrrolidon (PVP) entfernen, da PACs irreversible Interaktionen mit PVP eingehen. Mit dieser Methode wurde ein PAC-freier Extrakt hergestellt, der in vitro hinsichtlich antiadhäsiver Eigenschaften gegenüber verschiedenen UPEC-Stämmen getestet wurde. Auch hier wurden deutliche antiadhäsive Effekte gemessen, was zeigt, dass die PACs wahrscheinlich nicht als antiadhäsive Wirkstoffe in Betracht gezogen werden müssen.
Ein anderer Aspekt, der in der vorliegenden Studie interessant erscheint, ist die Frage, welche Adhäsionsfaktoren von UPEC durch Cranberry beeinflusst werden. Bisher sind vier unterschiedliche Adhäsionsfaktoren von UPEC bekannt:
- Typ-1-Fimbrien, die überwiegend Mannose-Einheiten des auf Blasenzellen zu findenden Glykoproteins Uroplakin erkennen, daran binden und somit hochspezifisch an die Wirtszelle andocken;
- P-Fimbrien, die galactosylierte Zuckerstrukturen auf der Wirtszelle erkennen und daran binden, sowie
- S- und F1C-Fimbrien, die aber wohl untergeordnete Bedeutungen haben.
UPEC, die von Typ-1-Fimbrien dominiert sind, finden sich bei über 90 Prozent aller UTI-Patienten, während P-Fimbrien-dominierte UPEC schwerpunktmäßig bei Patienten mit einer Pyelonephritis (Infektion der Niere) auftreten. Gezielte In-vitro-Untersuchungen verschiedener UPEC-Stämme mit definierter Ausstattung der Adhäsionsfaktoren zeigten klar, dass der untersuchte Cranberry-Extrakt keinerlei antiadhäsive Wirkung gegenüber P-Fimbrien-dominierten UPEC hat, wohl aber sehr starke Hemmwirkung gegenüber den Mannose-sensitiven Typ-1-Fimbrien-UPEC [3]. Dies widerlegt die Schlüsse aus den älteren Untersuchungen [2], die (wahrscheinlich voreilig) P‑Fimbrien als molekulare Targets definierten. Zudem ist offensichtlich, dass bei mechanistischen Studien mit Gerbstoff-haltigen Extrakten häufig falsch-positive Daten ermittelt werden können (PACs sind stark adstringierende Gerbstoffe!).
Nach den nun vorliegenden Befunden scheint klar, dass oral eingenommene Cranberry-Zubereitungen antiadhäsive Wirkungen gegenüber UPEC aufweisen, allerdings lediglich gegen Typ-1-Fimbrien-dominierte Stämme. Als Wirkstoffe können nicht mehr die PACs angesehen werden; stattdessen müssen wirksame Metaboliten durch gezielte analytische Untersuchungen des Urins behandelter Probanden identifiziert werden. Diesbezügliche Untersuchungen laufen bereits.
Aus dieser Sicht erscheinen Cranberry-Zubereitungen als interessante Strategie im Rahmen eines erweiterten Konzeptes zur Prävention von UTI. Allerdings sollte die Apotheke darauf achten, dass sie standardisierte Produkte abgibt. Die gezielte Entwicklung von Cranberry-Arzneimitteln mit entsprechender klinischer Evidenz würde viele gegenwärtige Probleme bezüglich Cranberry beheben helfen. |
Literatur
[1] S3-Leitlinie Harnwegsinfektionen bei Erwachsenen, unkompliziert bakteriell ambulant erworben: Epidemiologie, Diagnostik, Therapie und Management. AWMF-Registernummer 043-044 (Stand 1.6.2010)
[2] Foo L, et al. A-type proanthocyanidine trimers from cranberry that inhibit adherence of uropathogenic P-fimbriated Escherichia coli. J Nat Prod 2000;63:1225-1228
[3] Rafsanjany N, Sendker J, Brandt S, Dobrindt U, Hensel A. In vivo consumption of cranberry exerts ex vivo antiadhesive activity against fimH-dominated uropathogenic E. coli: A combined in vivo, ex vivo, and in vitro study of an extract from Vaccinium macrocarpon. J Agric Food Chem 2015;63:8804-8818



























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.