
- DAZ.online
- DAZ / AZ
- DAZ 33/2015
- Pioglitazon doch besser ...
Arzneimittel und Therapie
Pioglitazon doch besser als sein Ruf?
Das Risiko für Blasenkrebs wird neu bewertet
Nachdem einige Studien auf ein vermehrtes Auftreten von Blasenkrebs während einer antidiabetischen Behandlung mit Pioglitazon hinwiesen, verschärfte die europäische Arzneimittelagentur (EMA) die Anwendungsbeschränkungen für die Therapie. Kontraindiziert ist Pioglitazon demnach bei Patienten mit bestehendem Blasenkrebs bzw. Blasenkrebs in der Vorgeschichte. Gleiches gilt für Patienten mit nicht abgeklärter makroskopischer Hämaturie. Eine Notwendigkeit zum Ruhen der Zulassung, wie es die französische Arzneimittelbehörde nach Bekanntwerden der Studiendaten erwirkte, sah die EMA demnach (noch) nicht. Auch die FDA beließ es nur bei einem Warnhinweis zur möglichen Risikoerhöhung von Blasenkrebs.
Warum Pioglitazon mit einer erhöhten Rate an Blasenkrebs assoziiert sein könnte, ist derzeit jedoch noch nicht bekannt. Die Aktivierung von PPAR-γ-Rezeptoren scheint nicht daran beteiligt zu sein, da für Rosiglitazon kein erhöhtes Blasenkrebsrisiko gefunden wurde. Da Blasenkrebs zudem insgesamt selten ist und das Risiko erst ab einer Behandlungsdauer von mindestens zwei Jahren signifikant zu steigen scheint, wird das absolute Risiko für den einzelnen Patienten immer noch als gering eingeschätzt. Daher wurden die bisherigen Studien zu Blasenkrebs unter Pioglitazon-Therapie auch kontrovers diskutiert.
Um das tatsächliche Risiko für Krebserkrankungen unter Pioglitazon-Therapie zu evaluieren, bedarf es daher einer ausreichend großen Patientenpopulation sowie eines langen Nachbeobachtungszeitraumes. Die FDA beauftragte deshalb die Herstellerfirma (Takeda), die Inzidenz von Blasenkarzinomen unter Pioglitazon genauer untersuchen zu lassen.
Verordnung von Pioglitazon
Glitazone können seit 2011 nicht mehr zulasten der gesetzlichen Krankenversicherung (GKV) verordnet werden. Der G-BA hat sie von der Verordnung ausgeschlossen, da er ein negatives Kosten-Nutzen-Verhältnis sah. Da Rosiglitazon (zum Beispiel Avandia®, Avandamet® oder Avaglim®) seit November 2010 in Deutschland aufgrund von kardialen Risiken nicht mehr im Handel ist, ist nur Pioglitazon inklusive der Kombinationen (zum Beispiel Actos®, Compact® oder Tandemact®) betroffen. Es kann in medizinisch begründeten Einzelfällen verordnet werden. So ist zum Beispiel für Patienten, die mit Metformin nicht therapiert werden können, eine Pioglitazon-Verordnung weiterhin möglich.
Nicht mehr Blasenkrebs, aber …
Die Ergebnisse der auf zehn Jahre angelegten Kohorten- sowie Fall-Kontroll-Analyse wurden nun veröffentlicht [1]. Dafür wurden Daten von 193.099 Diabetikern im Zeitraum von 1997 bis 2012 untersucht, wobei 34.181 Personen (18%) für median 2,8 Jahre (0,2 – 13,2 Jahre) mit Pioglitazon behandelt wurden. Die Anwendung von Pioglitazon war dabei nicht mit einem erhöhten Blasenkrebsrisiko assoziiert (HR 1,06; 95% KI, 0,89 – 1,26). Darüber hinaus ergab sich auch kein Zusammenhang zwischen dem Risiko für Blasenkrebs und der Dauer der Pioglitazon-Verabreichung oder erhöhten kumulativen Pioglitazon-Dosen. Ähnliches ergab sich für die Inzidenz acht anderer Krebsarten wie Brust-, Lungen-, Endometrium- oder Kolonkarzinom. Für die Entstehung von Prostata- bzw. Pankreaskrebs (HR 1,13; 95% KI, 1,02 – 1,26 bzw. HR 1,41; 95% KI, 1,16 – 1,71) zeigte sich allerdings ein erhöhtes Risiko im Vergleich zu Patienten ohne Pioglitazon-Therapie.
Die Autoren der Studie befürworten aufgrund der erhöhten Inzidenz von Prostata- und Pankreaskarzinomen die Durchführung weiterer Studien, um entweder eine eventuelle Kausalität zur Pioglitazon-Behandlung nachzuweisen oder um auszuschließen, dass die vermutete Assoziation auf Zufallsdaten oder ungeklärten Störfaktoren beruht. Bezüglich des Risikos für Blasenkrebs geben die Wissenschaftler jedoch Entwarnung, obwohl ein erhöhtes Risiko, das bisher auch aus anderen Studiendaten erhoben wurde, weiterhin nicht komplett auszuschließen ist.
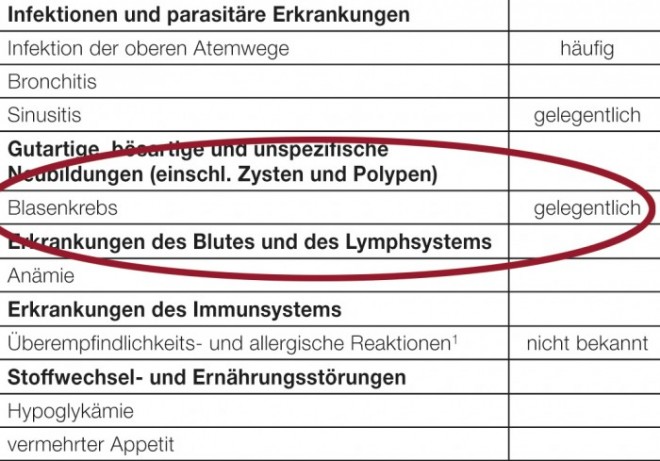
Abb.: In der aktuellen Fachinfo von Actos 45 mg wird die Häufigkeit für „Blasenkrebs“ unter Pioglitazon mit gelegentlich angegeben.
Evaluation ist nicht beendet
Die vorliegenden Daten zur Post-Marketing-Analyse von Pioglitazon verdeutlichen die Schwierigkeiten, mit denen die entsprechenden Hersteller, unabhängige Arzneimittelkommissionen sowie die behandelnden Ärzte und Apotheker konfrontiert sind, um für die Patienten eine optimale Arzneimitteltherapie bei gleichzeitig ausreichender Sicherheit zu gewährleisten [2, 3]. Trotz aufwendiger Evaluierungen möglicher Risiken einer Arzneimittelbehandlung während der klinischen Phase 3 finden sich bestimmte Assoziationen zu relativ seltenen Erkrankungen zumeist erst im Rahmen der Behandlung einer breiten Patientenschaft nach Zulassung des Medikaments. Die möglichen Folgen einer solchen Risikoerhöhung reichen von einer einfachen Weiterverfolgung der Ereignisse, über eine Ergänzung von Warn- und Anwendungshinweisen bis hin zum Ruhen der Zulassung. In den jeweiligen Risikobewertungsverfahren müssen die vorliegenden Daten dabei sorgfältig und genau geprüft werden, wobei die verfügbaren Studien oftmals auch methodische Mängel aufweisen. Eine optimale Maßnahme zur Risikominimierung sollte dabei stets die Patientensicherheit im Fokus haben, ohne dabei zu strikt die Möglichkeiten einer wirksamen Arzneimitteltherapie zu beschränken und möglicherweise auf eine effektive, zum Teil lebensnotwendigen Medikation zu verzichten. Die Evaluation zur Sicherheit von Pioglitazon ist auch mit den vorliegenden Studiendaten noch nicht beendet. Die möglichen Risiken zur Entstehung von Prostata- und Pankreaskrebs werden auch diesmal die Arzneimittelkommissionen aufhorchen lassen, wonach mit weiteren Maßnahmen zur Bewahrung der Patientensicherheit zu rechnen ist. |
Quellen
[1] Lewis JD, Habel LA, Quesenberry CP, et al. Pioglitazone Use and Risk of Bladder Cancer and Other Common Cancers in Persons With Diabetes. JAMA. 2015;314(3):265-277. doi:10.1001/jama.2015.7996.
[2] Sharfstein JM, Kesselheim AS. The Safety of Prescription Drugs. JAMA. 2015;314(3):233-234. doi:10.1001/jama.2015.7151.
[3] Fontanarosa PB, Bauchner H, Golub RM. Evaluating Research on the Safety of Medical Therapies: The Responsibility of Journals to the Health of the Public. JAMA. 2015;314(3):235-236. doi:10.1001/jama.2015.8232.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.