
- DAZ.online
- DAZ / AZ
- DAZ 38/2014
- Gegenschub
Neurologie
Gegenschub
Neue Perspektiven in der Pharmakotherapie der multiplen Sklerose
Grundlagen und Fakten zur multiplen Sklerose
Die multiple Sklerose ist eine autoimmun induzierte neurologische Entzündungserkrankung. Die Krankheit ist chronisch und durch einen schubförmigen Verlauf gekennzeichnet. Ihre Pathologie ist in einem Einwandern autoreaktiver T-Lymphozyten sowie Makrophagen in das zentrale Nervensystem, das heißt in Gehirn und Knochenmark begründet. Dort attackieren die reaktiven Abwehrzellen die Myelinscheiden der Axone, so dass „multiple“ entzündliche Entmarkungsareale resultieren. Diese können nach einem akuten Krankheitsschub narbig wieder verheilen, „sklerosieren“. Beim Auftreten eines Krankheitsschubes können die Entzündungsherde im ZNS vielfältige neurologische Symptome induzieren, die von den häufig auftretenden Seh- und Sprachstörungen über Schmerzen, Taubheitsempfindungen bis zu Gangunsicherheiten und Lähmungen führen.
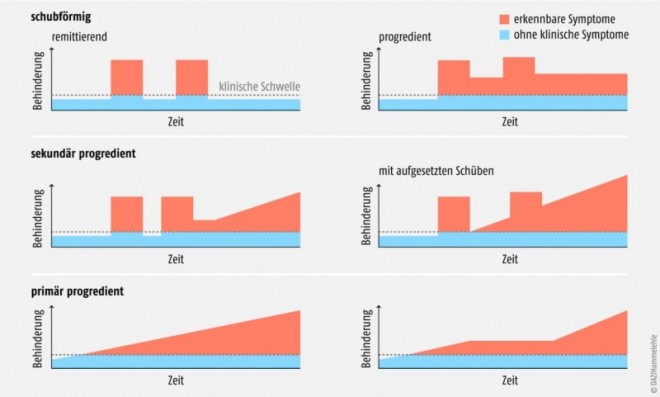
Für die Erkrankung werden drei unterschiedliche Verlaufsformen beschrieben (s. Abb. 1). Bei circa 90% der Neuerkrankten tritt eine schubförmig remittierende MS (relapsing remitting; RRMS) auf. Dabei sind die Krankheitsschübe durch multiple Entzündungsherde mit Symptomen gekennzeichnet, die nach einem Auftreten von mindestens 24 Stunden wieder vollständig oder nahezu vollständig abklingen. Bei der sekundär progredienten MS (SPMS) ist dagegen nach den erfolgten Schüben eine höhere und ansteigende Restaktivität der Krankheit zu verzeichnen. Nach einer längeren Erkrankungszeit ist bei vielen Patienten ein Übergang von der RRMS zur SPMS sichtbar. Die dritte Verlaufsform (primär progrediente MS; PPMS) äußert sich durch eine kontinuierliche Verstärkung der Krankheitsintensität ohne ausgesprochene Schubaktivität.Weltweit sind ca. zwei Millionen Menschen von dieser Erkrankung betroffen, in Deutschland sind ca. 130.000 Menschen an MS erkrankt. Die multiple Sklerose tritt zumeist zwischen dem 20. und 40. Lebensjahr auf, Frauen zeigen eine deutlich höhere Erkrankungsquote. Die Ätiologie der MS-Erkrankung, das heißt, die Ursache der auftretenden Autoaggressivität der Lymphozyten ist noch immer unbekannt. Dahingegen sind aber Krankheit-verursachende Faktoren gut in ihren Zusammenhängen erfasst. Eine genetische Ursache besteht, der Beitrag einer bestimmten Gendisposition zur Erkrankung wird aber nur als moderat eingestuft. Vielmehr sind äußere Faktoren zur Induktion der multiplen Sklerose sehr wahrscheinlich. Hohe Spiegel an Vitamin D werden mit einem Schutz vor autoimmunen Entzündungserkrankungen in Zusammenhang gebracht, wodurch sich auch die geografischen Unterschiede in der Erkrankungsstatistik der MS erklären ließen. Am häufigsten kommt sie zwischen dem 40. und 60. Grad nördlicher Breite und dem 30. bis 40. Grad südlicher Breite vor. Des Weiteren wird eine vorangegangene Infektion der MS-Patienten mit einem Epstein-Barr-Virus in einen funktionellen Zusammenhang gebracht, da offensichtlich diese Viren eine Anfälligkeit gegen autoimmune Erkrankungen erhöhen. Rauchen ist als MS-forcierender Faktor gut belegt; weiterhin werden Einflüsse des intestinalen Mikrobioms (Darmbakterienflora) auf die Krankheitsentstehung diskutiert.
Pharmakotherapie der MS allgemein
Aufgrund der ungeklärten Ätiologie stellt die multiple Sklerose eine unheilbare Krankheit dar. Ziel einer Pharmakotherapie ist es, durch immunmodulierende oder immunsupprimierende Wirkstoffe die Anzahl sowie die Intensität der Krankheitsschübe zu reduzieren und dadurch die Behinderungsprogression einzudämmen. Angestrebt wird eine frühestmögliche Erkennung erster Krankheitssymptome als Voraussetzung für einen sofortigen Therapiebeginn. Hierfür haben neue diagnostische Methoden, insbesondere bildgebende Verfahren in den letzten Jahren große Fortschritte erbracht.
Da mit der Pharmakotherapie sensibel in das Immunsystem eingegriffen wird, sollten die Patienten intensiv betreut werden. Bei optimalem Therapieerfolg muss ein ausreichender Immunstatus erhalten bleiben, um die Lebensqualität sowie Aktivität der Patienten möglichst wenig einzuschränken. Nach Aussagen der Deutschen Multiple Sklerose Gesellschaft (DMSG) nimmt Deutschland im europäischen Vergleich den Spitzenplatz in der Versorgung der Patienten ein.
Die Anzahl der Wirkstoffe zur MS-Therapie war über viele Jahre im Vergleich zu anderen Indikationen relativ gering und ist erst in neuester Zeit durch innovative Arzneistoffe bereichert worden. Entsprechend der aktuell geltenden Leitlinien der Deutschen Gesellschaft für Neurologie (aktualisiert April 2014 [1]) wird eine MS-Therapie zusammengesetzt aus:
- einer Basistherapie mit immunmodulatorischen Wirkstoffen für eine dauerhafte Anwendung,
- einer Eskalationstherapie mit immunsuppressiven Wirkstoffen als Dauer- oder Stoßtherapie bei Versagen der Basistherapie und bei aggressiv verlaufenden Erkrankungen sowie
- einer Therapie der akuten Schübe, für die hohe Dosierungen von Methylprednisolon für drei bis fünf Tage angewendet werden.
Die etablierte Basistherapie
Eine rationale immunmodulierende Pharmakotherapie der MS-Erkrankung wurde vor circa 20 Jahren mit der Einführung der parenteral anzuwendenden Interferon-beta-1-Präparate als erste Basistherapeutika eingeleitet. Interferone gehören zur Familie der Zytokine und sind antiviral, antiproliferativ sowie immunmodulatorisch wirksam. Die zur Therapie zugelassenen rekombinanten Interferone beta-1a sowie beta-1b unterscheiden sich herstellungsbedingt nur strukturell geringfügig, nicht aber in ihrer Wirksamkeit.
Interferon beta-1a (Avonex®, Rebif®; ein- bis dreimal wöchentliche Applikation i.m. oder s.c.) wie auch Interferon beta-1b (Betaferon®; Applikation s.c. alle zwei Tage) wirken modulierend auf die myelinschädigende Autoimmunreaktion sowie Inflammation und verhindern so die Schubhäufigkeit und Krankheitsprogression. Der genaue Wirkmechanismus ist nicht in allen Einzelheiten bekannt, eine Aktivierung antiinflammatorischer Zytokine sowie eine reduzierte Aktivierung von TH1-Helferzellen gelten als gesichert. Die häufigste Nebenwirkung bei der Interferon-Anwendung besteht im Auftreten grippeähnlicher Symptome. In einer aktuellen Information (19.08.14) verweist das BfArM auf mögliche seltene Nebenwirkungen der Beta-Interferone auch nach langen Behandlungszeiträumen durch Auftreten einer thrombotischen Mikroangiopathie (TMA), d.h. Bildung okklusiver mikrovaskulärer Thromben oder eines nephrotischen Syndroms. Es wird dabei auf die Beachtung früher klinischer Symptome (TMA: Thrombozytopenie, Hypertonie, Fieber; Ödeme oder Proteinurie beim nephrotischen Syndrom) hingewiesen. Der ärztliche Beirat der Deutschen Multiple Sklerose Gesellschaft verweist auf die Notwendigkeit regelmäßiger Kontrollen der klinischen Symptomatik, sieht aber keine Notwendigkeit, das Nutzen-Risiko-Verhältnis der Interferon-Gabe negativer zu bewerten oder gut vertragene Therapien abzubrechen. Mit ihrer Zulassung zur Behandlung der RRMS und SPMS sind die Interferone mit Abstand die am häufigsten angewendeten MS-Therapeutika.Mit Extavia® existiert seit 2009 ein Bioidentical des Interferon beta-1b (Betaferon®) auf dem Markt, welches sich bei struktureller Identität nur hinsichtlich des Applikationssystems vom Ursprungsprodukt unterscheidet.
Im Juli 2014 erhielt ein mit Polyethylenglykol modifiziertes Interferon beta-1a (Plegridy®) die Zulassung zur MS-Basistherapie in Europa. Wie auch von anderen therapeutisch eingesetzten Proteinen bekannt bewirkt die „PEGylierung“ eine deutliche Verlängerung der Zirkulationszeit und damit der Wirkdauer, so dass Plegridy® nur einmal im zweiwöchigen Abstand subkutan appliziert werden muss. Die aktuelle Zulassungsstudie ADVANCE belegt ein günstiges, der konventionellen Interferon-Therapie analoges Sicherheitsprofil [2].
Glatirameracetat (Copaxone®) ist seit 2001 eine Alternative zum Interferon in der Basistherapie von RRMS-Patienten. Glatirameracetat ist ein heterogenes Peptidgemisch einer durchschnittlichen Größe von fünf bis neun kDa mit einer festgelegten Relation der Aminosäuren Glutaminsäure, Lysin, Tyrosin und Alanin. Dadurch ähnelt es offensichtlich strukturell dem Myelin-basischen Protein, einem wichtigen Bestandteil der Myelinscheiden der Axone, was seine immunmodulatorische Wirksamkeit erklären könnte. Glatirameracetat senkt die Schubrate, kann aber auch nicht dauerhaft eine Behinderungsprogression der behandelten Patienten aufhalten.
Große Vergleichsstudien in den letzten Jahren haben eine grundsätzliche Gleichwertigkeit der Beta-Interferone mit Glatirameracetat in der Verringerung der Autoimmunreaktion bei RRMS-Patienten bewiesen. Trotzdem spricht ein relativ hoher Prozentsatz von Patienten (ca. 30%) nicht oder nicht ausreichend auf die genannten Optionen einer Basistherapie an.
Neue Aspekte der Basistherapie
Seit 2011 wurden drei oral anwendbare Wirkstoffe (Fingolimod, Teriflunomid und Dimethylfumarat) für die MS-Therapie zugelassen, wovon zwei die Basistherapie bereichern können.
Seit Oktober 2013 steht Teriflunomid (Aubagio®) für die Basistherapie erwachsener RRMS-Patienten mit einer einmal täglichen oralen Anwendung von 14 mg zur Verfügung. Teriflunomid ist eigentlich schon länger bekannt, denn als aktiver Metabolit des seit 1999 in der Therapie der rheumatoiden Arthritis zugelassenen Leflunomid ist der Wirkstoff de facto seit 15 Jahren etabliert. Als selektiv reversibler Hemmstoff des Enzyms Dihydroorotat-Dehydrogenase in den Mitochondrien greift Teriflunomid blockierend in die Pyrimidin-de-novo-Synthese ein und hemmt somit die Proliferation von T- und B-Lymphozyten. Bedingt durch diesen Wirkmechanismus ist Teriflunomid bei Schwangerschaft streng kontraindiziert. Auch bei Patienten mit beeinträchtigtem Immunstatus, Leberfunktionsstörungen oder dialysepflichtigen Nierenfunktionsstörungen darf es nicht angewendet werden. Da Teriflunomid einem enterohepatischen Kreislauf unterliegt, resultiert eine sehr lange Zirkulationshalbwertzeit von circa 19 Tagen.
Teriflunomid senkt die Schubrate bei Patienten mit schubförmig remittierender MS signifikant um circa 35% sowie auch die Behinderungsprogression. Trotzdem wurde Teriflunomid durch das IQWiG im Januar 2014 „kein belegter Zusatznutzen“ im Vergleich zur Basistherapie mit Interferon beta-1a zugesprochen. Begründet wird dies bei vergleichbar guter Wirksamkeit beider Basistherapeutika mit der Tatsache, dass diese sich nur im Spektrum der Nebenwirkungen, nicht aber deren Intensität unterscheiden. Trotzdem kann Teriflunomid, insbesondere hinsichtlich des seit Jahren überschaubaren Sicherheitsprofils, als ein wichtiger Beitrag zur Basistherapie der MS angesehen werden.
Auch Dimethylfumarat (Tecfidera®; Zulassung durch die FDA März 2013; Zulassung durch die EMA März 2014) als neue orale Option einer Basistherapie von RRMS-Patienten ist hinsichtlich seiner immunmodulatorischen Eigenschaften nicht unbekannt. Bereits in den 50er Jahren wurden Fumarsäure-Derivate als effektiv zur Behandlung der Psoriasis vulgaris, ebenfalls einer T-Zell induzierten autoimmunen Erkrankung, experimentell beschrieben [3]. Das seit 1994 in der Therapie der Schuppenflechte eingesetzte Substanzgemisch (Fumaderm®) enthält neben Salzen der Fumarsäuremonoethylester auch Dimethylfumarat.
Für die antiinflammatorischen sowie neuroprotektiven Wirksamkeiten des Dimethylfumarats wird die Aktivierung eines Signalweges zur Entzündungsabwehr (Nrf2-ARE-Signalweg) verantwortlich gemacht. Dieser führt zu einer Normalisierung des zellulären Energiehaushaltes sowie zu einer Detoxifizierung durch den Abbau oxidativ geschädigter Proteine. Eine reduzierte Expression proinflammatorischer Zytokine sowie des neurotoxischen Stickstoffmonoxids ergänzen das Wirkspektrum des Dimethylfumarats.
Nach einwöchiger geringerer Anfangsdosis wird Dimethylfumarat zweimal täglich mit 240 mg eingenommen. Eine Wirkung setzt aber erst circa zwei Monate nach Therapiebeginn ein. Als häufige Nebenwirkungen werden Magen-Darm-Beschwerden sowie das Auftreten eines plötzlichen Hitzegefühls (Flush) berichtet. Durch die Gefahr eines akuten Nierenversagens unter Dimethylfumarat-Therapie wird aktuell auf eine regelmäßige Kontrolle der Nierenfunktion hingewiesen. Als Immunmodulator beeinflusst Dimethylfumarat die zelluläre Immunabwehr und induziert eine verminderte Leukozytenzahl (Leukopenie), weshalb vor Behandlungsbeginn und in zeitlichen Abständen von circa sechs Monaten ein großes Blutbild der Patienten aufgenommen werden sollte. Wie auch andere immunmodulatorische Wirkstoffe kann Dimethylfumarat Patienten für sekundäre, zumeist virale Infektionen sensibilisieren.
In der im August 2014 veröffentlichten Bewertung sieht das IQWiG in der Anwendung von Dimethylfumarat keinen belegbaren Zusatznutzen gegenüber der zweckmäßigen Vergleichstherapie [4]. Dieses Urteil basiert aber insbesondere auf Kritikpunkten an den eingereichten Studien.
Eskalationstherapie
Bei Versagen einer Basistherapie oder bei einer hochaktiven RRMS kann das seit 2006 zugelassene Natalizumab (Tysabri®) als Monotherapie mit einer monatlichen intravenös Applikation von 300 mg angewendet werden. Natalizumab ist ein Antikörper gegen das Adhäsionsmolekül Integrinα4 auf Lymphozyten. Durch dessen Blockade können die Lymphozyten das Gefäßsystem nicht mehr verlassen und somit auch die Blut-Hirn-Schranke nicht überwinden. Natalizumab zeigte als Eskalationstherapeutikum in den Zulassungsstudien herausragende Effekte zur Verminderung der Schubhäufigkeit von Patienten mit schubförmig remittierender MS. Aber bereits kurz nach der Zulassung 2004 in den USA führte der mit Natalizumab verbundene immunsuppressive Effekt zum Auftreten schwerwiegender Komplikationen in Form einer progressiv multifokalen Leukenzephalopathie (PML). Diese durch Polyoma-Viren (JC-Virus) induzierte zentral fortschreitende entzündliche Erkrankung war auch von anderen immunsupprimierten Patienten (HIV) bekannt. Da die Inzidenz einer progressiv multifokalen Leukenzephalopathie mit der Länge der Behandlungsdauer zuzunehmen scheint, wird seit 2006 die längerfristige Anwendung von Natalizumab unter Auflage einer engmaschigen PML-Kontrolle gestellt, was auch 2010 Inhalt eines Rote-Hand-Briefes war [5]. Das errechnete Risiko, nach einer 18 Monate dauernden Natalizumab-Therapie an PML zu erkranken, liegt bei ca. 1:1000. Unter Beachtung der Auflagen kann für Natalizumab mit seiner sehr guten Wirksamkeit und vergleichsweise guten Verträglichkeit ein ausgesprochen positives Nutzen-Risiko-Verhältnis gezogen werden.
Sollen sich MS-Patienten impfen lassen?
Impfungen können modulierend auf das Immunsystem wirken. Daher kann die Möglichkeit nicht ausgeschlossen werden, dass ein Krankheitsschub von Autoimmunerkrankungen bzw. Erkrankungen, bei denen das Immunsystem eine Rolle spielt, durch Impfungen ausgelöst werden. Nach Angaben der Ständigen Impfkommission am Robert Koch-Institut (STIKO) konnte aber in bisherigen Studien ein solcher Zusammenhang nicht belegt werden. Nach Impfungen von MS-Patienten gegen Tetanus, Influenza sowie Hepatitis B wurde kein Unterschied im weiteren Krankheitsverlauf der MS zwischen Geimpften und Nicht-Geimpften beobachtet. Prinzipiell ist die multiple Sklerose keine Kontraindikation zur Durchführung einer Impfung! Da virale Infektionen nachweislich ein Trigger für MS-Schübe sein können, schätzt die STIKO den Nutzen von Impfungen mit Totimpfstoffen grundsätzlich größer als jedes theoretische Risiko ein. Es wird aber empfohlen, virale Lebendimpfstoffe nur nach sorgfältiger Nutzen-Risiko-Abwägung zu verabreichen. Die STIKO empfiehlt MS-Patienten neben den Standardimpfungen ausdrücklich die Influenzaimpfung, wenn die Schübe ihrer MS-Erkrankung durch Infektionen getriggert werden.
[Quelle: Impfthemen von A-Z. Robert Koch-Institut, www.rki.de]
Mit Fingolimod (Gilenya®) wurde im April 2011 der erste oral wirksame Arzneistoff in die MS-Therapie eingeführt, der mit einem völlig neuartigen Wirkprinzip die Eskalationstherapie von RRMS-Patienten (Monotherapie, einmal täglich 0,5 mg) bereichert. Fingolimod wird metabolisch phosphoryliert und ähnelt so strukturell dem Sphingosinphosphat, einem Lipidmediator im Organismus. Als Modulator an Sphingosin-1-Phosphat-Rezeptoren (S1PR) entfaltet Fingolimod seine für die Therapie der multiplen Sklerose maßgebende immunsuppressive Wirksamkeit. Es gibt fünf Subtypen der Sphingosin-1-Phosphat-Rezeptoren, S1PR1 bis S1PR3 kommen ubiquitär im Körper vor, S1PR4 nur auf Zellen des lymphatischen und hämatopoetischen Gewebes und S1PR5 auf Oligodentrozyten der Markscheiden um die Axone im ZNS. Fingolimod bindet hauptsächlich die Subformen 1, 4 und 5. Durch agonistische Aktivität an S1PR1, in deren Folge die Rezeptoren internalisiert werden, verhindert Fingolimod den Austritt von Lymphozyten aus den lymphatischen Organen in Entzündungsgebiete im ZNS. So bewirkt Fingolimod eine Lymphopenie, nicht aber eine reduzierte Aktivität der T-Zellen. Bereits 16 Stunden nach Erstanwendung resultiert eine reduzierte Lymphozyten-Anzahl im Blut um circa 25%, die bei längerer Anwendung weiter vermindert wird. Inwieweit auch eine remyelinisierende Wirkung durch Agonismus an den S1PR5 positiv zur MS-Therapie beiträgt, ist nicht geklärt.
In den Zulassungsstudien zeigte Fingolimod eine signifikante Reduktion der jährlichen Schubrate von über 50%. Nebenwirkungen sind mit den immunsuppressiven Effekten zu erklären, die sich in erhöhten Infektionsanfälligkeiten (Herpes-Infektionen) der Patienten manifestierten. In sehr seltenen Fällen kann der Eingriff in die immunologische Balance auch zu schwerwiegenden Nebenwirkungen führen. Virale Infektionen mit dem Auftreten eines sogenannten hämophagozytischen Syndroms führten in zwei Fällen zum Tode der behandelten Patienten und waren Anlass für einen Rote-Hand-Brief des Herstellers Novartis im November 2013 [6].
Da S1PR3 auf Zellen des Reizleitungssystems des Herzen verstärkt vorkommen, ist eine vorübergehende Abnahme der Pulsfrequenz bei Beginn der Fingolimod-Therapie erklärlich. Somit bedarf es einer kontinuierlichen EKG-Überwachung und Blutdruckkontrolle innerhalb der ersten Therapietage. Bei einer strengen Indikationsstellung, einem engen therapeutischen Monitoring und der Einhaltung von Vorsichtsmaßnahmen stellt Fingolimod für Patienten mit einem aggressiven Krankheitsverlauf eine große therapeutische Bereicherung dar.
Mit großem Echo wurde im September 2013 Alemtuzumab (Lemtrada®) in die Therapie der schubförmig remittierenden MS (RRMS) als Eskalationstherapeutikum eingeführt. Die Diskussion zielte dabei insbesondere auf den Indikationswechsel dieses Antikörpers. Alemtuzumab war früher als Präparat zur Behandlung der chronisch lymphatischen Leukämie vom B-Zell–Typ (MabCampath®) indiziert und wurde 2012 vom Markt genommen. 2013 wurde es als MS-Therapeutikum mit einem – bezogen auf die Wirkstoffmenge – deutlich höheren Preis wieder eingeführt. Dieses „Indikations-Hopping“ wurde von verschiedenen Seiten scharf kritisiert, die FDA hat bisher eine Zulassung für die neue Indikation verwehrt (der Neuantrag wurde im April 2014 gestellt). Alemtuzumab bindet das auf T- und B-Lymphozyten exprimierte CD52-Epitop. Daraus resultiert eine durch das Komplementsystem sowie die antikörperabhängige, zellvermittelte Zytotoxizität induzierte Depletion dieser zirkulierenden Abwehrzellen. Alemtuzumab wird als Stoßtherapie angewendet, wobei die Patienten an fünf aufeinander folgenden Tagen je 12 mg des Wirkstoffes intravenös erhalten. Erst nach zwölf Monaten erfolgt eine weitere Therapie mit einer dreimaligen Applikation. In den Zulassungsstudien war Alemtuzumab signifikant dem hochdosierten Interferon beta-1a hinsichtlich Reduktion der Schubanfälligkeit und des Fortschreitens einer Behinderung überlegen. Darauf bezog sich auch die Argumentation zur Preisfindung des Präparats durch den Hersteller Genzyme. Basierend auf einem fünfjährigen Zeitraum mit nur zwei Stoßtherapien ist Alemtuzumab dann preislich günstiger als Beta-Interferon.
Durch den Eingriff in das Immunsystem verursacht Alemtuzumab verschiedene Nebenwirkungen. Neben einer generell erhöhten Infektionsanfälligkeit kann es auch zu schwerwiegenden Autoimmunstörungen wie Schilddrüsenerkrankungen führen. Der Hersteller bietet daher ein langfristiges, auch über die akuten Applikationszeiträume hinausgehendes Risk-Management-Programm für die Patienten an.
Wirkstoffe in der Entwicklung
Verschiedene Wirkstoffkandidaten, die hinsichtlich des Wirkmechanismus ein interessantes Spektrum repräsentieren, befinden sich in der Pipeline der pharmazeutischen Entwicklung. Bei den rekombinanten Proteinarzneistoffen sind einige Antikörper weit in der Entwicklung fortgeschritten.
Ocrelizumab, ein in Phase III befindlicher humanisierter Antikörper gegen das auf B-Lymphozyten exprimierte CD20, induziert eine Depletion der B-Zellen und zeigt damit funktionelle Analogien zum Rituximab, das seit vielen Jahren zur Leukämiebehandlung und der Therapie der rheumatoiden Arthritis etabliert ist.
Daclizumab HYP (high-yield process) ist ein humanisierter Antikörper gegen CD25 am IL-2-Rezeptor der T-Lymphozyten. Er beeinflusst Proliferation und Differenzierung dieser Zellen. Der in Phase III der klinischen Entwicklung befindliche Antikörper überzeugt in seiner Wirksamkeit [7] und ist strukturell nahezu analog zu dem früheren Immunsuppressivum Daclizumab (Zenapax®).
Secukinumab, ein humaner Antikörper gegen Interleukin 17 (IL-17), befindet sich in Phase II der klinischen Entwicklung zur Anwendung in der MS-Therapie.
Auch chemisch definierte Strukturen (small molecules) stellen aussichtsreiche Wirkstoffkandidaten dar. Beispielsweise ist mit Siponimod ein dem Fingolimod ähnlicher Sphingosin-1-Phosphat-Rezeptoren(S1PR)-Modulator in Phase III der Entwicklung, der sich durch eine selektivere Rezeptormodulation auszeichnet und für die Anwendung bei der Therapie der sekundär-chronisch progredienten MS (SPMS) entwickelt wird. Auch Ponesimod, gegenwärtig in Phase II, soll über diesen Wirkmechanismus immunsuppressiv wirken. Der als sicher eingeschätzte immunmodulatorische Kandidat Laquinimod wurde im Mai 2014 wegen Sicherheitsbedenken seitens der EMA in seiner Zulassung abgelehnt.
MS-Patienten in der Apotheke
Patienten mit multipler Sklerose werden durch ihre behandelnden Neurologen in ihrer Therapie generell intensiv begleitet, so dass sie zumeist sehr gut über Anwendung, Wirkung und Nebenwirkungen der Arzneistoffe informiert sind. Auch wenn die Apotheker nicht in diese Behandlungsschemata eingreifen, ergibt sich bei MS-Patienten in der Apotheke ein vielfältiger Ansatz zur pharmazeutischen Beratung, der wiederum hohe Ansprüche an den Kenntnisstand der Apotheker über die Krankheit und Therapie stellt.
Praktische Fragestellungen, wie beispielsweise die Kompatibilität der Applikationssysteme für unterschiedliche Interferon-Präparate sind hierbei sicher sehr häufig.
Der Apotheker ist besonders gefordert, Arzneimittelwechselwirkungen zu verhindern. Während die beschriebenen Biologicals hierbei kaum Ansätze bieten, ist beispielsweise bei der Anwendung von Teriflunomid auf verschiedene Interaktionen über das Cytochrom-P450-System zu achten. Als moderater Hemmstoff des CYP2C8 sowie schwacher Induktor des CYP1A2 kann Teriflunomid die Wirkstoffspiegel anderer Arzneistoffe beeinflussen.
Schmerz ist eine häufige Begleiterscheinung der MS-Erkrankung, die aber aufgrund ihrer pathologischen Ursachen nicht mit den klassischen Analgetika behandelt wird. Auch wenn die Nebenwirkungen der MS-Therapeutika umfassend beschrieben sind, ist eine depressive Verstimmung der Patienten, zumeist bei Therapiebeginn, oftmals nicht dokumentiert und sollte von den Apothekern entsprechend berücksichtigt werden.
Bei einer angestrebten körperlichen Aktivität und Bewegung der Patienten gibt es keine spezifischen Ernährungshinweise bei dieser Erkrankung, auch ist ein moderater Alkoholkonsum, entsprechend einer aktuellen Studie [8], nicht als Risikofaktor der Krankheitsprogression anzusehen.
Ausblick
Die therapeutischen Optionen für MS-Patienten haben sich in den letzten Jahren durch innovative neue Wirkprinzipien deutlich verbessert. Die Krankheit wird nicht nur besser verstanden und schneller diagnostiziert, sie kann auch selektiver behandelt werden. Dies alles führt zu einer breiteren Akzeptanz eines Lebens mit der MS-Erkrankung.
Nichtsdestotrotz greift man mit den vorgestellten Wirkstoffen in sensibler Weise in das Immunsystem ein, dies bedarf einer engen therapeutischen Überwachung und Begleitung der Patienten, an der auch die Apotheker in ihrer Beratungstätigkeit beteiligt sein müssen.
Literatur
[1] Aktualisierte Leitlinie der DGN zur Diagnose und Behandlung der MS, Stand April 2014: www.dgn.org/leitlinien-online-2012/inhalte-nach-kapitel/2333-ll-31-2012-diagnose-und-therapie-der-multiplen-sklerose.html
[2] Press release von Biogen Idec zur Zulassung von Plegridy® vom 23. Juli 2014, www.biogenidec.com/press_release_details.aspx?ID=14712&Action=1&NewsId=2367&M=NewsV2&PID=61997
[3] Schweckendieck, W. Heilung von Psoriasis. Med. Mschr. (1959)13;103-104
[4] Bewertung des Dimethylfumarats durch IQWiG vom 1. August 2014, www.iqwig.de/de/presse/pressemitteilungen/pressemitteilungen/dimethylfumarat_bei_ms_zusatznutzen_ist_nicht_belegt.6230.html
[5] Rote Hand Brief zur Anwendung von Natalizumab, Februar 2010, www.akdae.de/Arzneimittelsicherheit/RHB/Archiv/2010/20100305.pdf
[6] Rote Hand Brief zur Anwendung von Fingolimod vom 15. November 2013, www.akdae.de/Arzneimittelsicherheit/RHB/Archiv/2013/20131115.pdf
[7] Gold R et al. Daclizumab high-yield process in relapsing-remitting multiple sclerosis (SELECT): a randomised, double-blind, placebo-controlled trial. Lancet. (2013)381;2167-2175
[8] Hedström AK et al Alcohol as a modifiable lifestyle factor affecting multiple sclerosis risk. JAMA Neurol. (2014)71;300-305


 Prof. Dr. Gerd Bendas studierte Pharmazie an der Martin-Luther-Universität Halle. Nach anschließender Promotion erfolgte 2000 die Habilitation für das Fachgebiet Pharmazeutische Chemie. Seit 2003 hat er eine Professur für Pharmazeutische Chemie an der Universität Bonn inne.
Prof. Dr. Gerd Bendas studierte Pharmazie an der Martin-Luther-Universität Halle. Nach anschließender Promotion erfolgte 2000 die Habilitation für das Fachgebiet Pharmazeutische Chemie. Seit 2003 hat er eine Professur für Pharmazeutische Chemie an der Universität Bonn inne.
















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.