
- DAZ.online
- DAZ / AZ
- DAZ 9/2013
- Unser Immunsystem
UniDAZ
Unser Immunsystem
EditorialLiebe Leserinnen, liebe Leser! Der März ist ein gefürchteter Monat für viele Pharmaziestudierende, genauer: für diejenigen im vierten Fachsemester. Nach dem Grundstudium müssen sie im ersten Teil der pharmazeutischen Prüfung nachweisen, ob sie sich genügend Fachwissen angeeignet haben, um zum Hauptstudium zugelassen zu werden. Wer es geschafft hat, atmet freier, und mancher fragt sich nun zum ersten Mal, was nach dem Ende des Studiums auf ihn zukommt, wie die Berufstätigkeit als Apotheker wohl aussehen mag. Die Neugier auf den künftigen Beruf ist für viele Pharmaziestudierende ein Motiv, die Interpharm zu besuchen. Auf diesem alljährlichen Fortbildungskongress erleben sie in Vorträgen und Diskussionen, welche Themen den gestandenen Apothekern am Herzen liegen und mit welchen Problemen sie sich auseinandersetzen. Zudem gibt es auf jeder Interpharm einen Programmpunkt, der für Studierende und Pharmazeuten im Praktikum besonders interessant ist: die Verleihung des UniDAZ Wissenschaftspreises. In diesem Jahr findet die Interpharm vom 15. bis 17. März in Hamburg statt. Studierende und PhiPs erhalten 50% Rabatt. Apropos UniDAZ: Sie ist ja nicht nur eine Rubrik in der DAZ, sondern auch ein Magazin, das zweimal im Jahr erscheint. Die nächste Ausgabe kommt Mitte März an Ihre Unis und bringt wieder interessante Beiträge zu den Themen Studium, Wissenschaft und Berufsstart. Besuchen Sie uns auch mal auf unserer Website www.unidaz.de, und wenn Sie Kritik üben wollen oder Wünsche haben, schreiben Sie uns ein Mail! Ihre UniDAZ-Redaktion |
Uns geht es gut – meistens jedenfalls. Und dabei laufen tagtäglich viele kleinere und größere "Kämpfe" in unserem Körper ab, die wir üblicherweise gar nicht bemerken. Zu verdanken haben wir diesen sehr effizienten Schutz vor pathogenen Eindringlingen unserem Immunsystem, das auf einer bemerkenswerten Kooperation bestimmter Zellen und Proteine beruht, die ständig auf Patrouille sind, Fremdkörper erkennen und sie beseitigen.
Ohne Immunsystem können wir nicht (über)leben
Wie wichtig das Immunsystem ist, sieht man an den sogenannten "Bubble Babies". Diese Kinder werden mit unterschiedlichen Mutationen im Genom geboren, sodass wesentliche Funktionen des Immunsystems fehlen. Man nennt diese sehr seltene Krankheit auch SCID (severe combined immunodeficiency). Die betroffenen Kinder müssen in einem sterilen Zelt leben, damit sie nicht an Infektionen mit alltäglichen Krankheitskeimen sterben.
Ein wesentlicher Bestandteil unseres Immunsystems sind Haut und Schleimhäute, die sehr effizient Erreger abwehren können. Wie wichtig die Haut mit ihrer Schutzfunktion ist, sieht man an Personen, die ihre Haut durch schwere Verbrennungen teilweise verloren haben. Ohne Haut fehlt ihnen nicht nur die wichtige, mechanische Barriere gegen Viren, Bakterien, Pilze oder sonstige Schädlinge, sondern es sind zum Teil auch Zellen und Proteine geschädigt, die normalerweise als erste Abwehr parat stehen, um Eindringlingen etwas entgegenzusetzen. Deshalb ist die erhöhte Infektionsgefahr ein massives Problem bei großflächigen Verbrennungen.
Die Erstabwehr: das angeborene Immunsystem
Was passiert eigentlich im Verlauf eines Infekts in unserem Körper? Selbst bei einer intakten Körperoberfläche schaffen es Viren, Bakterien oder eukaryontische Pathogene immer wieder, in unseren Körper einzudringen. Dort erwartet sie bereits das angeborene Immunsystem mit seinen spezialisierten Zellen – Makrophagen, dendritische Zellen, Granulozyten und Natürliche Killerzellen – und löslichen Proteinen des Komplementsystems.
Tab. 1: Mustererkennungs-Rezeptoren und die erkannten Strukturen (Beispiele) | ||
Typ |
Rezeptor |
Ligand |
Lösliche Rezeptoren in Körperflüssigkeiten |
Mannose-bindendes Lektin (MBL) |
Mannosereste auf Bakterien |
Surfactant-Protein A und D |
Zuckerstrukturen auf Bakterien |
|
C-reaktives Protein (CRP) |
Phosphatidylcholin |
|
LPS-bindendes Protein (LBP) |
Lipopolysaccharide (LPS) auf Bakterien |
|
Zelloberflächenrezeptoren |
Mannose-Rezeptoren |
Mannosereste auf Bakterien |
Scavenger-Rezeptoren |
Acylierte Lipoproteine |
|
CD14 |
LPS-LBP-Komplexe |
|
Intrazelluläre Rezeptoren |
dsRNA-abhängige Proteinkinase |
Virale doppelsträngige RNA |
RIG-I-ähnliche RNA-Helicasen |
Virale doppel- und einzelsträngige RNA |
|
NOD-ähnliche Rezeptoren (NLR) |
Peptidoglykane, Flagellin von Bakterien |
|
Das angeborene Immunsystem schützt uns von Geburt an und ist phylogenetisch sehr alt, denn ähnliche Systeme finden sich bereits bei wirbellosen Tieren. Da es eine erste, recht allgemeine Abwehrreaktion bewirkt, wird es auch häufig noch als "unspezifisches" Immunsystem bezeichnet. Mittlerweile weiß man aber, dass das angeborene Immunsystem keineswegs vollkommen unspezifisch ist. Sogenannte Mustererkennungs-Rezeptoren (engl. pattern recognition receptors, PRR) spielen hier eine entscheidende Rolle. Zum Beispiel erkennen das Mannose-bindende Lektin oder die Toll-like Rezeptoren (TLR) ganz charakteristische "Muster" bei den Krankheitserregern (Tab. 1 und 2).
Tab. 2: Humane Toll-like Rezeptoren und ihre Liganden | |
Rezeptor |
Ligand (Auswahl) |
TLR1 |
Bakterielle Triacyl-Lipopeptide |
TLR2 |
Peptidoglykan, Lipoteichonsäuren, Lipoarabinomannane, Zymosan |
TLR3 |
Virale doppelsträngige RNA |
TLR4 |
Lipopolysaccharide, RSV-F-Protein |
TLR5 |
Flagellin |
TLR6 |
Diacyl-Lipopeptide von Mycoplasma, Lipoteichonsäuren, Zymosan |
TLR7 |
Virale einzelsträngige RNA |
TLR8 |
Virale einzelsträngige RNA |
TLR9 |
Unmethylierte CpG-DNA |
TLR10 |
Ligand noch nicht genau bekannt |
Der Vorteil des angeborenen Immunsystems ist die direkte Verfügbarkeit und die schnelle Reaktion auf die Eindringlinge innerhalb von Minuten bis wenigen Stunden. Der Nachteil ist, dass das angeborene Immunsystem kein Gedächtnis hat: Selbst wenn wir jedes Jahr mit den gleichen Schnupfenviren konfrontiert werden, kann das angeborene Immunsystem immer nur nach dem gleichen Schema und mit der gleichen Geschwindigkeit reagieren.
Betrachten wir nun die "Player", also die beteiligten Proteine und Zellen des angeborenen Immunsystems etwas genauer.
Das Komplementsystem
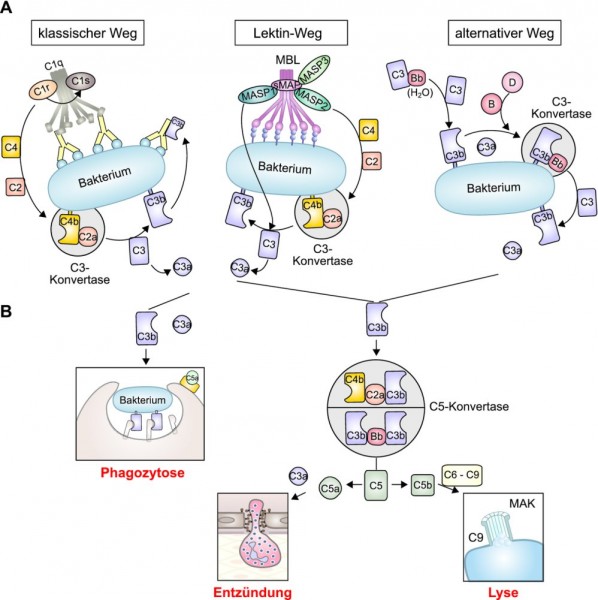
Das Komplementsystem bekam seinen Namen vor mehr als 100 Jahren, als entdeckt wurde, dass eine Kaskade von verschiedenen Enzymen die Antikörperantwort bei einer Infektion ergänzt (komplementiert) und zur Lyse der eingedrungenen Bakterien führt. Allerdings weiß man inzwischen, dass der "klassische Weg" (s. u.) nur eine von drei Möglichkeiten ist, das Komplementsystem in Gang zu bringen. Mehr als 30 Proteine sind als Aktivatoren und Regulatoren an dem Kaskadensystem beteiligt. Die eigentlichen Komplementfaktoren werden mit C1 bis C9 bezeichnet. Dies sind Zymogene – inaktive Enzymvorstufen – , die nacheinander proteolytisch gespalten und dadurch aktiviert werden. So kommt es – analog zum ähnlich funktionierenden Blutgerinnungssystem – zu einer Verstärkung der primären Effekte.
Klassischer Weg und Lektin-Weg: Ein Signal, das das Komplementsystem aktivieren kann, ist ein Proteinkomplex auf dem Bakterium, der beim klassischen Weg durch Antigene, beim Lektin-Weg über die Mustererkennung des Mannose-bindenden Lektins (MBL) zustande kommt (Abb. 1A links und Mitte). Das Signal induziert die Spaltung der Komplementfaktoren in ihre a- und b-Fragmente. Das Fragment C3b ist ein Opsonin, d. h. es bindet direkt an Bakterien, und ein opsonisiertes Bakterium ist besonders attraktiv für die Makrophagen oder "Fresszellen", die das Bakterium schnell durch Phagozytose beseitigen (Abb. 1B links).
Alternativer Weg: Hier wird der Komplementfaktor C3 durch das Fragment Bb gespalten, worauf C3b an das Bakterium bindet (Abb. 1A rechts).
Bei allen drei Wegen entsteht das Fragment C5b, das die Komplementfaktoren C6 bis C9 an die Bakterienoberfläche holt, wo sie den sogenannten Membran-Angriffskomplex (MAK) bilden und C9-Moleküle eine Pore in der Bakterienwand formen. Darauf geht das perforierte Bakterium durch Lyse zugrunde (Abb. 1B rechts).
Die Fragmente C3a und C5a wirken als sogenannte Anaphylatoxine, die weitere Makrophagen anlocken und eine Entzündungsreaktion einleiten. (Anaphylatoxine spielen auch außerhalb des Immunsystems eine Rolle: Sie bewirken eine Kontraktion der glatten Muskulatur, z. B. in den Bronchien, und eine Erhöhung der Kapillarpermeabilität.)
Das Mannose-bindende Lektin und die Komplementfaktoren patrouillieren ständig in unserem Körper. Insofern ist es nicht verwunderlich, dass diese "schnelle Einsatztruppe" bereits wenige Stunden nach dem Eindringen eines Pathogens mit dessen Elimination beginnt.
Immunkompetente Zellen
Aus Monozyten, die aus dem Blutkreislauf in verschiedene Gewebe eingewandert sind, entwickeln sich Makrophagen.
Je nach Umgebung werden sie beispielsweise auch Mikrogliazellen (Gehirn) oder Kupffer-Zellen (Leber) genannt. Makrophagen exprimieren verschiedene Rezeptoren auf ihrer Oberfläche, über die sie Bakterien erkennen und binden können. Anschließend "fressen" (phagozytieren) sie die Bakterien, indem sie sie mit der eigenen Zellmembran umschließen und im Phagolysosom verdauen.
Makrophagen, die unterhalb der Haut und Schleimhäute lauern, beginnen dort sofort mit der Bekämpfung der Eindringlinge. Gleichzeitig schütten "fressende" Makrophagen verschiedene Botenstoffe aus, wie den Tumornekrosefaktor alpha (TNF-α) oder die Interleukine IL-1β und IL-6, die wiederum neutrophile Granulozyten, Natürliche Killerzellen (NK-Zellen) und weitere Monozyten aus dem Blut anlocken, die sich an der Elimination der Eindringlinge beteiligen.
Granulozyten werden wegen der ungewöhnlichen Form des Zellkerns auch als polymorphkernige Leukozyten bezeichnet. Ihren Namen haben die Granulozyten von körnigen Strukturen, den Granula, die bewirken, dass verschiedene Typen der Zellen unterschiedlich anfärbbar sind: So gibt es eosinophile, basophile und neutrophile Granulozyten. Bei der angeborenen Immunantwort spielen jedoch nur die neutrophilen Granulozyten eine Rolle. Auch sie können Bakterien binden und phagozytieren, sie sind allerdings wesentlich kurzlebiger als Makrophagen. Demgegenüber sind eosinophile und basophile Granulozyten eher in die Abwehr von größeren Parasiten involviert und spielen – zum Leidwesen der Betroffenen – bei einigen allergischen Reaktionen eine Rolle.
Eine dritte Gruppe phagozytierender Zellen, die sich wie Makrophagen ebenfalls im Gewebe aufhalten und direkt bereit sind, Bakterien zu "fressen", sind dendritische Zellen. Ihren Namen haben sie von fingerförmigen Fortsätzen, die an die Dendriten von Nervenzellen erinnern. Dendritische Zellen nehmen ständig Material aus ihrer Umgebung auf (Endozytose) und fressen dabei auch Bakterien. Vor allem sind sie aber darauf spezialisiert, Antigene zu präsentieren und darüber das adaptive Immunsystem zu stimulieren: Wenn sie – wie die Makrophagen (s. o.) – die gefressenen Bakterien in ihre Phagolysosomen aufgenommen haben, verdauen sie sie nicht vollständig, sondern bringen kleine Bruchstücke des Pathogens, z. B. ein Oligopeptid aus einem Protein, mithilfe des Haupthistokompatibilitätskomplex (major histocompatibility complex, MHC) an die Zelloberfläche und zeigen sie dort der Umgebung. Welche Konsequenz das hat, werden wir bei der Betrachtung des adaptiven Immunsystems genauer besprechen.
Die Abwehrmechanismen, die wir uns bisher angesehen haben, funktionieren vor allem bei Pathogenen, die sich außerhalb von Körperzellen befinden. Was hat aber unser Immunsystem gegen Viren oder Mykobakterien aufzubieten, die sich in ihren Wirtszellen verschanzt haben? In diesem Fall sind die Natürlichen Killerzellen (NK-Zellen) gefragt. Sie erkennen mithilfe spezieller Rezeptoren auf ihrer Oberfläche, wenn sich Körperzellen auf irgendeine Weise krankhaft verändern, sei es, dass sie intrazellulär infiziert oder aber zu einer Tumorzelle mutiert sind. Sobald NK-Zellen eine derart schadhafte Zelle ausfindig machen, sezernieren sie Granula mit zytotoxischen Proteinen, sodass die kranke Zelle zugrunde geht.
Die Spezialtruppe: das adaptive Immunsystem
Im Vergleich zum angeborenen Immunsystem besitzen die Komponenten des adaptiven Immunsystems hochspezifische Erkennungsmoleküle für die verschiedenen Bakterien und Viren. Auch hier arbeiten lösliche Proteine (Antikörper) und Lymphozyten (B- und T-Zellen) zusammen. Die B-Zellen sind für die Bildung der Antikörper verantwortlich. Die T-Zellen lassen sich grob in die Gruppen der zytotoxischen T-Zellen, der regulatorischen T‑Zellen und der T-Helferzellen einteilen, die jeweils spezielle Aufgaben haben.
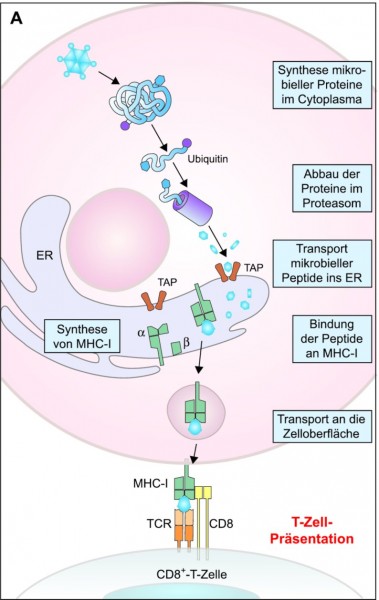
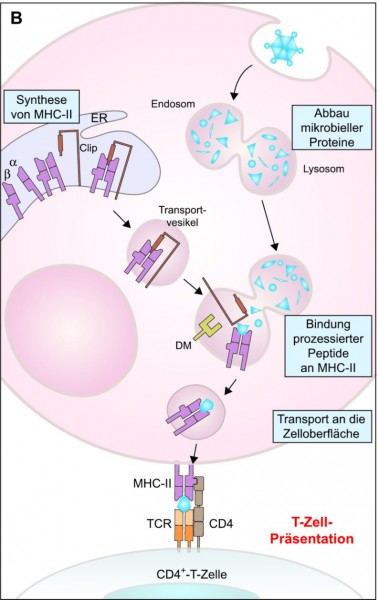
Der wesentliche Schritt zur Einleitung der adaptiven Immunantwort ist die Präsentation von antigenen Strukturen, wie bereits bei den dendritischen Zellen erwähnt. Präsentiert werden Oligopeptide mithilfe der Oberflächenproteine MHC-I und MHC-II.
Der 1. Schritt: Antigenpräsentation
Die MHC-Moleküle sind Membranproteinkomplexe, die auch als menschliche Leukozytenantigene (engl. human leukocyte antigen, HLA) bezeichnet werden. Während MHC-II-Moleküle auf den antigenpräsentierenden Zellen vorkommen, sind MHC-I-Moleküle auf allen kernhaltigen Zellen (also nicht auf Erythrozyten) zu finden. Sie sind interindividuell sehr unterschiedlich (dies wirkt sich auch auf die Immunreaktion nach Transplantationen aus). Die MHC-I-Moleküle präsentieren dem Immunsystem Oligopeptide mit acht bis zehn Aminosäuren, während die Peptide in MHC-II-Molekülen in ihrer Länge stärker variieren. MHC-I-Moleküle erhalten ihre Peptide aus dem "Schredder" der Zelle, dem Proteasom (Abb. 2A). Im Proteasom zerlegen Proteasen Proteine in Oligopeptide, die darauf mithilfe bestimmter Transportproteine zu den MHC-I-Molekülen in der Membran des Endoplasmatischen Reticulums geschafft werden. Sobald MHC-I mit einem geeigneten Peptid bepackt ist, kann es über Membranvesikel in die Cytoplasmamembran eingebaut und präsentiert werden. (Im Proteasom werden auch die nicht mehr benötigten Proteine des normalen Zellstoffwechsels abgebaut.)
MHC-II kommt auf allen antigenpräsentierenden Zellen vor, die Immunkomplexe und Pathogene phagozytieren können, also auf dendritischen Zellen und Makrophagen. Diese Zellen nehmen den Immunkomplex oder das Pathogen in ein Vesikel (Endosom) auf, das mit einem Lysosom verschmilzt (Abb. 2B). Anschließend werden Bruchstücke der "verdauten" Pathogene in die im Endoplasmatischen Reticulum synthetisierten MHC-II-Moleküle geschleust, und der gesamte Komplex wird zur Zellmembran transportiert und präsentiert.
Der 2. Schritt: Antigenerkennung
Die präsentierten Antigene werden von T-Zellen auf zwei Wegen erkannt: Zytotoxische T‑Zellen tragen auf ihrer Oberfläche CD8-Moleküle, die spezifisch mit MHC-I interagieren, während die CD4-Moleküle auf der Oberfläche von T-Helferzellen an MHC-II binden. Um das präsentierte Antigen zu binden, tragen T-Zellen jeweils einen passgenauen T-Zell-Rezeptor.
Die B-Zellen tragen auf ihrer Oberfläche B-Zell-Rezeptoren. Diese binden – im Unterschied zu den T-Zell-Rezeptoren – direkt an das Pathogen, ohne dass eine Präsentation über MHC erforderlich ist.
Erstaunlich ist bei der Antigenerkennung im adaptiven Immunsystem, dass sowohl T-Zell- als auch B-Zell-Rezeptoren sehr spezifisch mit dem Antigen interagieren, auch wenn das Bakterium oder das Virus zum ersten Mal den Menschen befallen hat. Wie kann dann schon ein passgenauer Rezeptor dafür vorhanden sein? Die Antwort ist: Die Rezeptoren sind zufällig entstanden und kommen in einer sehr hohen Variabilität vor, sodass sicherlich mindestens eine Zelle mit einem passenden Rezeptor vorhanden ist.
Sowohl für die T-Zell- als auch für die B-Zell-Rezeptoren liegt die genetische Information in den jeweiligen Vorläuferzellen quasi in Form eines Baukastensystems vor. Bei der Zellreifung werden dann zufällig einzelne Gen-Bausteine zusammengesetzt und variiert und bilden in jeder T- bzw. B-Zelle einen andersartigen Antigen-Rezeptor. Dabei entstehen so viele verschiedene Zellklone, dass im Prinzip alle möglichen Strukturen gebunden werden können – auch körpereigene. Damit sich das adaptive Immunsystem jedoch nicht gegen körpereigene Zellen richtet, lernen T- und B‑Zellen während ihrer Reifung im Thymus bzw. im Knochenmark, "eigen" von "fremd" zu unterscheiden. Nur solche Immunzellen dürfen im Körper zirkulieren, die nicht (!) die körpereigenen Proteine erkennen. Alle anderen T- und B‑Zellen, die während der Zelldifferenzierung auch entstehen, werden noch bei der Reifung aussortiert und einem kontrollierten Zelltod zugeführt. Das funktioniert in den meisten Fällen wirklich gut. Ausnahmen sind diejenigen Menschen, die unter Autoimmunerkrankungen leiden und entweder T-Zellen oder Antikörper entwickelt haben, die sich gegen körpereigene Strukturen richten.
Der 3. Schritt: Effektormechanismen
Wie sehen nun die konkreten Abwehrmechanismen aus? Beginnen wir mit dem "einfachsten" Fall, einer Zelle, die mit einem intrazellulären Virus oder Bakterium infiziert ist. Diese Zelle hat, wenn sie dem unspezifischen Angriff einer NK-Zelle entgangen ist, Antigene des Pathogens über MHC-I auf der Oberfläche präsentiert, die nun von einer spezifischen zytotoxischen T-Zelle mit CD8-Molekülen erkannt und über den T-Zell-Rezeptor gebunden wurden (Abb. 2A). Die zytotoxische T-Zelle wird dabei aktiviert und schüttet Effektormoleküle wie Perforine und Granzyme aus, die auf die gebundene Zelle todbringend wirken. Dieser Mechanismus gewährleistet also, dass infizierte Zellen (oder auch Tumorzellen) vom Immunsystem abgetötet werden.
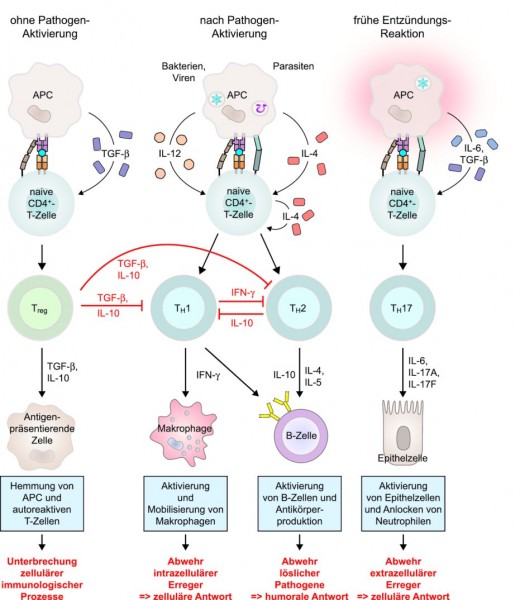
Etwas komplexer gestaltet sich das Bild bei den T-Zellen, die auf ihrer Oberfläche CD4-Moleküle tragen, die mit MHC-II interagieren (Abb. 2B). Je nachdem, in welchem Milieu die Interaktion zwischen den Zellen stattfindet und welche Signalmoleküle von der antigenpräsentierenden Zelle (APC) ausgeschüttet werden, entwickelt sich die CD4+ -T-Zelle zu einer TH1-, einer TH2-, einer TH17- oder einer regulatorischen T-Zelle (Abb. 3).
Die Effektormechanismen der Zellen sind recht unterschiedlich: TH1-Zellen aktivieren und mobilisieren Makrophagen und fördern die Abwehr intrazellulärer Erreger. TH2-Zellen (aber auch TH1-Zellen) helfen B-Zellen bei der Differenzierung zu Plasmazellen, die dann wiederum sehr spezifische Antikörper produzieren. Und TH 17-Zellen locken vor allem weitere neutrophile Granulozyten an, aktivieren Epithelzellen und sind an der Abwehr von extrazellulären Erregern beteiligt. Eine wichtige Rolle im Immungeschehen spielen die regulatorischen T-Zellen: Sie hemmen die aktivierten T‑Helferzellen und sorgen dafür, dass die Immunreaktion nicht überschießt.
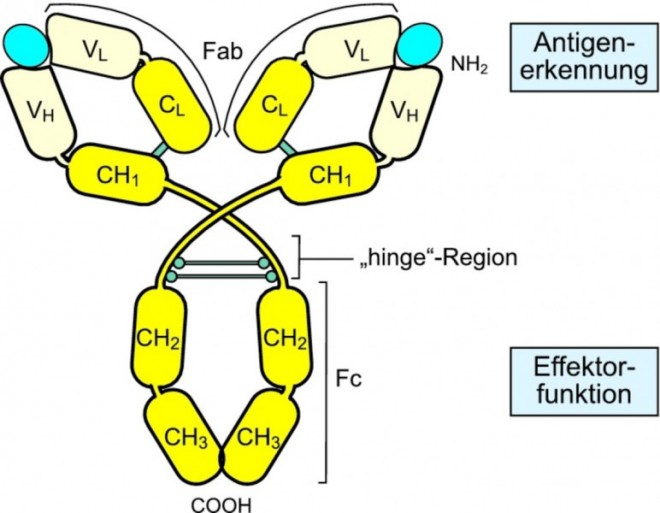
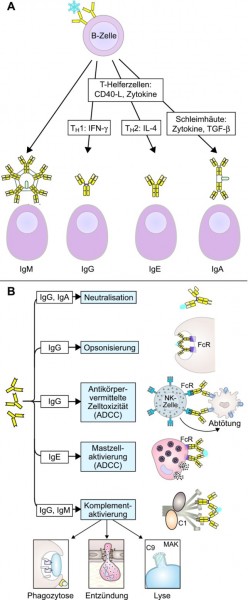
Fehlen jetzt noch die B-Zellen und ihre Antikörper bei der Betrachtung der adaptiven Immunantwort. Wenn B-Zellen über ihren B-Zell-Rezeptor ein Antigen erkannt und gebunden haben, werden sie aktiviert, teilen sich und entwickeln sich zu Plasmazellen, die nun eine lösliche Variante des ursprünglichen B-Zell-Rezeptors als Antikörper sezernieren. Interessanterweise gibt es in unserem Körper leicht unterschiedliche Antikörpermoleküle, die den Immunglobulin-Klassen IgM, IgD, IgG, IgE und IgA angehören (auch als Antikörper-Isotypen bezeichnet). Sie unterscheiden sich im Fc-Teil, für den es jeweils sehr spezifische Rezeptoren auf unterschiedlichen Zellen gibt. Dadurch werden ganz verschiedene Effektorfunktionen im Immunsystem ausgelöst (Abb. 4).
Je nachdem, welche T-Helferzelle und welche Signalmoleküle vorhanden sind, synthetisiert die B-Zelle durch einen Umbau der genetischen Information Antikörpermoleküle eines bestimmten Isotyps mit ganz bestimmten Effektorfunktionen (Abb. 5). Die antigenbindenden Fragmente (Fab) des Antikörpers bleiben davon zunächst unberührt, können aber später noch weiter an das Antigen angepasst werden. IgM- und IgD-Antikörper sind membranständig auf den B-Zellen und haben nur eine geringe Affinität zum Antigen. Am wichtigsten für die Abwehr von Krankheitserregern sind die IgG-Antikörper, die auch mengenmäßig im Blut dominieren und hochaffin an ihr jeweiliges Antigen binden; sie kommen vor allem in den Schleimhäuten vor. Eigentlich sind IgE-Antikörper wichtige Waffen gegen größere Parasiten; allerdings richten sie sich immer häufiger gegen an und für sich ungefährliche Fremdstoffe und führen zu den bekannten allergischen Reaktionen, indem sie z. B. Mastzellen veranlassen, Histamin auszuschütten.
Üblicherweise dauert es mehrere Tage, bis das adaptive Immunsystem voll einsatzfähig ist und erfolgreich die eingedrungenen Organismen bekämpft. Während dieser Tage fühlt man sich oft so richtig krank mit Fieber und Abgeschlagenheit, was auch Zeichen dafür sind, dass unsere Immunzellen jetzt so richtig aktiv werden und entsprechende Zytokine ausschütten. Erst durch das adaptive Immunsystem können wir den Parasiten, den Bakterien und Viren effizient begegnen und sie meistens auch besiegen.
Und Folgendes ist am adaptiven Immunsystem besonders gut: Einige der aktivierten, spezifischen B- und T-Zellen entwickeln sich zu Gedächtniszellen, die längere Zeit im Körper patrouillieren und bei einem erneuten Kontakt mit dem gleichen Antigen schnell aktiv werden. Diesen Effekt macht man sich beispielsweise bei der aktiven Immunisierung mit einem unschädlichen Antigen (Impfung) zunutze.
Zusammenfassung
Unser Immunsystem besteht aus löslichen Proteinen und aus Zellen, die teils eher unspezifisch, teils sehr spezifisch gegen Pathogene wirken. Interessant ist, dass alle Komponenten immer miteinander wechselwirken und sich gegenseitig aktivieren, sodass ein komplexes Netzwerk entsteht, das allen möglichen Krankheitserregern effizient entgegenwirken kann. Die alltägliche Leistung des Immunsystems bekommen wir meist gar nicht mit – schließlich sind wir ja gesund und fühlen uns auch so. So richtig aktiviert wird es, wenn wir uns beispielsweise einen grippalen Infekt einfangen. Und manchmal merken wir die Aktivierung des Immunsystems auch nach einer Impfung, wenn wir uns kurzfristig schlapp und vielleicht sogar etwas fiebrig fühlen: Dann arbeiten antigenpräsentierende Zellen, T-Zellen und B-Zellen, um uns für eine echte Infektion zu rüsten.
AutorenProf. Dr. Theo Dingermann ist Inhaber des Lehrstuhls für Pharmazeutische Biologie an der Goethe-Universität Frankfurt. Dr. Ilse Zündorf ist dort als akademische Oberrätin tätig. |
Anschrift:
Prof. Dr. Theo Dingermann,
Dr. Ilse Zündorf
Institut für Pharmazeutische Biologie
Biozentrum
Max-von-Laue-Straße 9
60438 Frankfurt/Main
Literaturtipp
Immunologie, die begeistert
Die Autoren dieses Buches betrachten die Immunologie aus der Sicht der Arzneimittelexperten. Neben dem immunologischen Grundwissen vermitteln sie ausführliche Informationen zu immunaktiven Arzneistoffen wie Immunsuppressiva, Stimulanzien, Impfstoffen, Seren und Immunglobulinen, Antikörpern und Antiallergika. Auch auf wichtige immunologische Methoden in Forschung und Diagnostik gehen sie ein. Informative Grafiken veranschaulichen die teils sehr komplexen Zusammenhänge.
Angelika Vollmar, Ilse Zündorf und Theodor Dingermann
Immunologie – Grundlagen und Wirkstoffe2. Auflage, XVIII, 451 Seiten, 241 farbige Abbildungen, 216 Tabellen, Geb. 59,80 Euro
Subskriptionspreis bis 31. März 2013: 49,– Euro
Wissenschaftliche Verlagsgesellschaft, Stuttgart 2012 ISBN 978-3-8047-2842-4Dieses Buch können Sie einfach und schnell bestellen
unter der Postadresse: Deutscher Apotheker Verlag Postfach 10 10 61 70009 Stuttgart
oder im Internet unter: www.buchoffizin.de
oder per Telefon unter: (07 11) 25 82 - 3 41 oder- 3 42





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.