
- DAZ.online
- DAZ / AZ
- DAZ 40/2013
- Sarkopenie und Frailty
Medizin
Sarkopenie und Frailty
Alt muss nicht gebrechlich bedeuten
Geprägt wurde der Begriff der Sarkopenie zum ersten Mal im Jahr 1989 von Irwin H. Rosenberg auf einer Konferenz in Albuquerque, New Mexico, um allgemein die alterskorrelierte Abnahme der Muskelmasse zu beschreiben. Abgeleitet aus dem Griechischen, bedeutet der Terminus soviel wie „Mangel an Fleisch“ (vgl. Sarkophag = „Fleischfresser“, Sarg). Die 2010 publizierte Definition der Europäischen Arbeitsgruppe zur Sarkopenie bei älteren Personen bezieht ausdrücklich die Muskelfunktion mit ein und beschreibt ein Syndrom, das durch einen progredienten und generalisierten Verlust von Masse sowie Kraft der Skelettmuskulatur gekennzeichnet ist [1].
Bei den von Sarkopenie Betroffenen steigt das Risiko für lebensverändernde Folgen, die sich in reduzierter körperlicher Leistungsfähigkeit und Mobilität, erhöhtem Sturz- und Frakturrisiko, Invalidität, Einschränkung einer selbstbestimmten Lebensführung, Rückgang der Lebensqualität und letztendlich in einer erhöhten Morbidität und Mortalität äußern können.
Keine krankheitsbedingte Alterung
Nach heutiger Einschätzung handelt es sich bei der Sarkopenie um einen primären, im Gegensatz zur Kachexie nicht krankheitsbedingten Alterungsprozess. Allerdings kann seine Ausprägung durch verschiedene Faktoren verstärkt werden, wie Komorbidität, körperliche Inaktivität bzw. Immobilität sowie Fehl- oder Mangelernährung.
Je nach Datenlage schwankt die Prävalenz bei 60- bis 70-Jährigen von fünf bis 13% und erreicht bei den über 80-Jährigen Werte bis zu 50%. In einer australischen Untersuchung lag die Prävalenz bei alten Menschen, die mehrere Stürze erlitten hatten, sogar bei 71%. Man geht davon aus, dass weltweit derzeit rund 50 Millionen Menschen von Sarkopenie betroffen sind und dass sich diese Zahl in den nächsten 40 Jahren auf etwa 200 Millionen erhöhen wird.
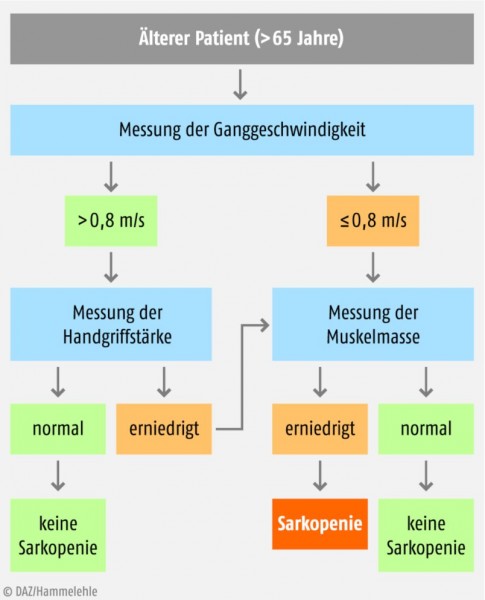
Um die klinische Diagnose einer Sarkopenie stellen zu können, reicht es nicht aus, die reduzierte Skelettmuskelmasse (Kriterium 1) darzustellen. Da Muskelmasse und -funktion nicht linear korrelieren, muss auch eine funktionelle muskuläre Einbuße nachweisbar sein: ein Rückgang der Kraft (Kriterium 2) und/oder der Leistungsfähigkeit (Kriterium 3).
Gangverlangsamung ist verdächtig
Dementsprechend lassen sich die funktionellen Kriterien durch einfache klinische Tests ermitteln:
- Muskelkraft (Kriterium 2). Die Messung der Handgriffstärke erlaubt eine durchaus zuverlässige Einschätzung, wie die Alltagsaktivitäten (engl. activities of daily life, ADL) bewältigt werden – auch wenn die Muskelkraft der Beine für den aufrechten Stand und Gang von größerer Bedeutung ist. Die Handgriffstärke gilt im Schnitt als vermindert, wenn sie bei Männern unter 30 kg und bei Frauen unter 20 kg beträgt, allerdings sind die Referenzwerte an das jeweilige Körpergewicht anzupassen.
- Körperliche Leistungsfähigkeit (Kriterium 3). Sie kann leicht anhand der Ganggeschwindigkeit ermittelt werden, daher bietet sich dieser Test als ideales Screeninginstrument an. Fällt die Ganggeschwindigkeit unter 0,8 Meter pro Sekunde (= 2,88 km/h), so deutet dies in der Regel auf eine eingeschränkte körperliche Leistungsfähigkeit hin. Auch andere Mobilitätstests können angewendet werden, etwa der „chair rising test“, bei dem der Patient fünfmal in Folge von einem Stuhl ohne Armlehne aufstehen muss. Benötigt er hierzu mehr als elf Sekunden, bedeutet dies im Allgemeinen eine relevante Kraftabnahme der Beine.
Den Algorithmus der europäischen Konsensusgruppe zur Diagnostik einer Sarkopenie aufgrund der Muskelfunktion zeigt Abbildung 1.
Nachweis reduzierter Muskelmasse
Der Nachweis einer reduzierten Muskelmasse allein durch klinische Untersuchungen wie die Messung des Waden- oder Oberarmumfangs ist unzuverlässig. Gerade bei älteren Menschen wird die abgebaute Muskelmasse durch Fettgewebe ersetzt, weshalb gleich bleibende Messwerte über eine tatsächlich bestehende Sarkopenie hinwegtäuschen können. Während im Bereich der Forschung die Computer- und Magnetresonanztomografie den Goldstandard bilden, werden in der klinischen Praxis weniger aufwendige technische Verfahren angewandt:
- Das Dual-Röntgen-Absorptiometrie-Verfahren (engl. dual-energy X-ray absorptiometry, DXA oder DEXA) ermöglicht es, zwischen Fettgewebe und fettfreiem Gewebe zu unterscheiden und damit die Muskelmasse abzuschätzen.
- Alternativ – auch mit tragbaren Geräten – kann eine Bioimpedanz-Analyse durchgeführt werden. Hier wird über zwei äußere Elektroden ein elektromagnetisches Feld im Körper aufgebaut. Diesem hochfrequenten Signal setzt der Körper einen elektrischen Widerstand – die Impedanz – entgegen, der von dem individuellen Anteil des Fettgewebes abhängig ist.
Bei beiden Verfahren gilt die Muskelmasse als erniedrigt, wenn der gemessene Wert niedriger ist als zwei Standardabweichungen gesunder junger Menschen.
Komplexe Pathogenese
Ab dem 50. Lebensjahr verliert der Mensch im Durchschnitt jährlich ein bis zwei Prozent seiner Skelettmuskelmasse. Die Abnahme der Muskelkraft beträgt 1,5 Prozent pro Jahr und steigt nach dem 60. Lebensjahr sogar auf drei Prozent. Periphere Muskelgruppen und die Muskulatur des Körperstamms sind gleichermaßen betroffen, vor allem in Bezug auf die schnell kontrahierenden Typ-II-Muskelfasern. Pathophysiologisch sind verschiedene alterskorrelierte Vorgänge in der Diskussion:
- Mit dem Alter nimmt die Synthese und Freisetzung anaboler Hormone und Proteine ab (Wachstumshormon, Insulin-like Growth Factor-1, Testosteron), was die Muskelmasse ab- und das viszerale Fettgewebe zunehmen lässt.
- Gleichzeitig steigt der Serumspiegel des Cortisols, das über verschiedene Mechanismen die Muskelproteinsynthese hemmt.
- Der Anstieg proinflammatorischer Zytokine, insbesondere Interleukin-6 und Tumornekrosefaktor-alpha, bedingt zum einen den enzymatischen Abbau von Muskelprotein, zum anderen ebenfalls eine reduzierte Proteinsynthese. Bei der Kachexie (siehe Textkasten) sind die Serumspiegel der proinflammatorischen Zytokine allerdings noch höher als bei der Sarkopenie.
- Neuere Untersuchungen sprechen dafür, dass auch die erhöhte Synthese von Myostatin im Alter zur Entwicklung der Sarkopenie beiträgt. Während der normalen Wachstumsphase verhindert dieses Protein (aus der Familie der Transforming Growth Factors, TGF) physiologischerweise ein überschießendes Muskelwachstum.
- Zumindest im Tierversuch konnte nachgewiesen werden, dass die Proteinsyntheserate und der oxidative Metabolismus in den Mitochondrien mit zunehmendem Alter abnehmen.
- Als Ursache für den Verlust an Muskelkraft wird zudem ein altersassoziierter Rückgang von alpha-Motoneuronen, die über die motorischen Endplatten die Skelettmuskelfasern innervieren und für die Muskelkontraktion zuständig sind, in Betracht gezogen.
Auch eine unzureichende Versorgung mit Proteinen und Mikronährstoffen hat zur Folge, dass im Alter sowohl Skelettmuskelmasse als auch -kraft abnehmen. Vor allem Vitamin D ist von besonderer Bedeutung für eine intakte Muskelfunktion. Hier zeigt sich auch eine Korrelation zwischen Sarkopenie und Malnutrition (siehe Textkasten).
Manchmal schwierig abzugrenzen: Kachexie und Malnutrition
Die Syndrome Sarkopenie, Kachexie und Malnutrition gehen jeweils mit einer bestimmten Konstellation des Gewichtsverlusts und des abgebauten Körpergewebes einher (Tab. 1). Sie können sich teilweise überlagern, was ihre Abgrenzung erschwert.
| Tab. 1: Abgrenzung der Sarkopenie von Kachexie und Malnutrition (nach [5]) | |||
| Syndrom | Muskelmasse | Fettmasse | Gewicht |
| Sarkopenie | ↓↓ | = | ↓ oder = |
| Kachexie | ↓↓↓ | ↓↓ | ↓↓↓ |
| Malnutrition | ↓ | ↓↓ | ↓↓ |
Bei der Kachexie kommt es zu einem progressiven und ausgeprägten Gewichtsverlust und Abbau vor allem von Muskelmasse. In der Regel besteht eine akute oder chronische Inflammation, was sich anhand erhöhter Konzentrationen von Akute-Phase-Proteinen wie C-reaktivem Protein (CRP) nachweisen lässt. In der Regel tritt eine Kachexie im Rahmen einer gravierenden Grunderkrankung auf, vor allem bei malignen Tumoren, chronischer Herzinsuffizienz, chronischer Niereninsuffizienz, chronisch-obstruktiver Lungenerkrankung, rheumatoider Arthritis und Aids.
Eine Malnutrition resultiert aus einer unzureichenden Nahrungsmenge bzw. Unterversorgung mit Kalorien, Proteinen, essenziellen Fettsäuren, Vitaminen und Mineralstoffen. Der Rückgang des Körpergewichts beruht hauptsächlich auf einem Abbau der Fettreserven. Die Ursachen beim älteren Menschen sind multifaktoriell:
- Veränderungen in der gastroenteral-endokrin-neuronalen Regulation führen häufig zu einem verminderten Hunger- und einem verstärkten Sättigungsgefühl.
- Akute oder chronische Erkrankungen können mit vermindertem Appetit einhergehen.
- Medikamente können zu Übelkeit oder Mundtrockenheit führen.
- Nicht zuletzt können sich verschlechterte psychosoziale Lebensbedingungen wie der Verlust des Ehepartners, aber auch depressive oder demenzielle Syndrome negativ auf die Ess- und Trinkgewohnheiten auswirken.
Rückgang von Reserven: Frailty
Häufig spielt die Sarkopenie eine zentrale Rolle in einem weiteren geriatrischen Syndrom, das ebenfalls leicht als Manifestation des normalen Alterns fehlgedeutet werden kann: Gebrechlichkeit, in der Fachliteratur meist mit dem englischen Terminus „frailty“ bezeichnet. Auch wenn sich die messbare Definition der Frailty hauptsächlich auf die physische Komponente stützt, sollten, um einen Fall individuell zu beurteilen, auch psychische und soziale Faktoren herangezogen werden. Ganz allgemein beschreibt die Frailty eine erhöhte Vulnerabilität des Organismus gegenüber verschiedenartigen externen und internen Störungen und Stressoren. Diese wiederum beruht auf einem komplexen und altersassoziierten Abbau von physiologischen Reserven des neuromuskulären, metabolischen und Immunsystems. International bestehen leider uneinheitliche Definitionen, doch in der klinischen Praxis werden häufig die fünf im Rahmen der Cardiovascular Health Study 2001 veröffentlichten Kriterien angewandt:
1. Unbeabsichtigter Gewichtsverlust (> 5 kg/Jahr)
2. Allgemeine Erschöpfung (vom Patienten subjektiv wahrgenommen)
3. Muskelschwäche, d.h. Abnahme der groben Kraft (Handkraftmessung)
4. Langsame Gehgeschwindigkeit
5. Geringe körperliche Aktivität (reduzierter Energieverbrauch).
Werden mindestens drei der genannten Kriterien erfüllt, gilt der Patient als gebrechlich. Durch Studien konnte nachgewiesen werden, dass auch Frailty häufiger mit körperlichen Behinderungen und Einbußen der Selbstständigkeit verbunden war sowie innerhalb von drei Jahren prädiktiv war für Stürze, Verschlechterung der Mobilität und Lebensqualität, Klinikeinweisung und Tod.
Daher liegt es nahe, dass die Syndrome Sarkopenie und Frailty sowohl klinisch als auch pathophysiologisch eng miteinander verbunden sind. Wie bei der Sarkopenie sind ursächlich ebenfalls inflammatorische Prozesse von Bedeutung. Die freigesetzten Zytokine bewirken die typischen Veränderungen wie den Abbau von Muskelprotein und eine verminderte Proteinsynthese.
Medikamente zur gezielten Behandlung von Sarkopenie und Frailty stehen gegenwärtig nicht zur Verfügung, sodass die Therapie derzeit auf zwei Säulen ruht:
- Steigerung der körperlichen Aktivität und
- Optimierung der Ernährung.
Grundsätzliches Ziel ist, den weiteren Abbau von Skelettmuskelmasse zu verhindern. Sarkopenie sollte zumindest in frühen Stadien als ein durchaus reversibler Prozess angesehen werden.
Auch im Alter Krafttraining
Da die hauptsächlich betroffenen schnellen Typ-II-Muskelfasern auf Krafttraining besser ansprechen als auf Ausdauertraining, sollte bei den Patienten ein aktives Muskeltraining an erster Stelle der Bewegungstherapie stehen. Sofern keine Kontraindikationen bestehen, spricht nichts dagegen, dass auch ältere Menschen unter kompetenter Anleitung ein klassisches Krafttraining an Geräten, mit Freihanteln und am Kabelzug absolvieren. Idealerweise sollte zwei- bis dreimal pro Woche an nicht aufeinander folgenden Tagen trainiert werden; empfohlen werden im Schnitt drei Durchgänge pro Übung mit 10 bis 15 Wiederholungen.Generell bewirkt Krafttraining eine vermehrte Einlagerung kontraktiler Proteine in den Skelettmuskel. Wie mehrfach nachgewiesen werden konnte, erhöht Krafttraining beim älteren Menschen nicht nur die Muskelmasse, sondern ist auch dazu geeignet, die Muskelkraft zu erhalten oder sogar zu vergrößern. In einer amerikanischen Studie zum systematischen Training gegen Widerstand konnten über 70 Jahre alte Menschen ihre Muskelkraft um bis zu 38% steigern. Dies kann dazu beitragen, funktionelle Bewegungsabläufe zu verbessern, was wiederum zu höherer Alltagskompetenz und Lebensqualität führen kann.
Betroffenen, die aufgrund gesundheitlicher Probleme kein intensives Training durchführen können, stehen weniger belastende Alternativen zur Verfügung:
- Ein Ganzkörper-Vibrationstraining (Whole Body Vibration, WBV), bei dem die übende Person auf einer vibrierenden Platte steht, löst Muskelkontraktionen und -eigenreflexe aus. Der Trainingseffekt ist durchaus mit dem eines „klassischen“ Fitnesstrainings vergleichbar.
- Bei einer Ganzkörper-Elektromyostimulation (WB-EMS) werden Muskelzellen über Oberflächenelektroden durch niederfrequente elektrische Impulse mit niedriger Stromstärke innerviert. In einer Studie der Universität Erlangen-Nürnberg mit über 70 Jahre alten sportlich inaktiven Frauen zeigte sich, dass ein WB-EMS-Training verschiedene Sarkopenieparameter signifikant besser beeinflusste als ein leichtes „Bewegungsprogramm“.
Optimierung der Eiweißzufuhr
Was die Ernährung betrifft, so ist die positive Korrelation zwischen Proteinaufnahme und Muskelaufbau seit Langem bekannt. Mehrere Studien weisen darauf hin, dass der Proteinbedarf im Alter insgesamt erhöht ist, da ältere Menschen zur Bildung der gleichen Menge an Muskelproteinen eine höhere Eiweißzufuhr benötigen.
Für alle sportlich nicht aktiven Menschen – junge Erwachsene ebenso wie Menschen über 65 Jahre – empfiehlt die Deutsche Gesellschaft für Ernährung (DGE) als Minimum eine tägliche Proteinzufuhr von 0,8 g pro kg Körpergewicht. Demgegenüber raten verschiedene Experten, dass ältere Menschen eine höhere Proteinmenge zu sich nehmen sollten, etwa 1,0 bis 1,5 g pro kg Körpergewicht und Tag. Die optimale Tagesdosis im Falle einer Sarkopenie wird sogar im Bereich zwischen 1,2 und 2,0 g pro kg Körpergewicht vermutet.
In erster Linie sind essenzielle (nicht im Körper gebildete) Aminosäuren für die Stimulation der muskulären Proteinsynthese verantwortlich. Unter ihnen scheint Leucin eine zentrale Rolle zu spielen, da mehrere Untersuchungen dafür sprechen, dass gerade diese verzweigtkettige Aminosäure für eine signifikante Steigerung der Proteinsynthese bei älteren Menschen ausschlaggebend ist.
Nicht abschließend geklärt ist derzeit, nach welchem Regime eine optimale Proteinzufuhr stattfinden soll. Zum einen wird empfohlen, die tägliche „Eiweißportion“ gleichmäßig auf die drei Hauptmahlzeiten zu verteilen, zum anderen wird argumentiert, dass ein eiweißreiches Mittagessen mit bis zu 80% der Tagesdosis, gefolgt von einer proteinarmen Mahlzeit am Abend, die Proteinaufnahme erhöhe.
In bestimmten Fällen kann auch eine Supplementierung von Proteinen angezeigt sein, etwa bei inadäquaten Ernährungsgewohnheiten oder wenn eine Mangelernährung im Vordergrund steht. Was ergänzende bilanzierte Diäten mit essenziellen Aminosäuren betrifft, so zeigte sich eine Wirkung bei Sarkopenie nur, wenn der Leucin-Anteil mit 41% relativ hoch war (demgegenüber wirkte bei Jüngeren schon ein Anteil von 26% muskelaufbauend).
Nicht nur für die Knochen wichtig: Vitamin D
Von enormer Bedeutung bei Sarkopenie ist auch die ausreichende Versorgung mit Vitamin D.
Die Bindung von 1,25-Dihydroxy-Vitamin D, dem aktiven Vitamin-D-Hormon, an seinen (hochspezifischen) Rezeptor fördert die Proteinsynthese, was letztendlich die Muskelkraft und körperliche Leistungsfähigkeit verbessert. So konnte in einer Studie die Muskelkraft gesteigert werden, wenn die Serumkonzentration des 25-Hydroxy-Vitamins D von 10 auf 40 nmol/l (d.h. von 4 auf 16 ng/ml) erhöht wurde. Einen dosisabhängigen Effekt auf das Sturzrisiko belegte eine Metaanalyse aus acht randomisierten klinischen Studien: Tägliche Vitamin-D-Gaben bis 600 I.E. zeigten keine ausreichende Wirkung, während eine Dosis von 700 bis 1000 I.E. mit einem Rückgang des Sturzrisikos um 19% korrelierte. In vielen Fällen dürfte es gerade alten Menschen nicht gelingen, ihren Tagesbedarf über natürliche Lebensmittel und die Exposition gegenüber dem Sonnenlicht zu decken. Daher wird eine tägliche Supplementierung von 700 bis 800 I.E. Vitamin D als sinnvoll angesehen.
Da oxidativer Stress und inflammatorische Mechanismen in der Pathophysiologie von Sarkopenie und Frailty eine wichtige Rolle spielen, spricht der bekannte entzündungshemmende Effekt von Omega-3-Fettsäuren für den Verzehr von Nahrungsmitteln mit einem hohen Gehalt dieser Fettsäuren. Ebenso von Bedeutung ist es, an Antioxidanzien reiche Nahrungsmittel zu sich zu nehmen, vor allem
- Obst und Gemüse (Vitamin C, Carotinoide),
- pflanzliche Öle, Weizenkeime und Nüsse (Vitamin E),
- Fisch und Eier (Vitamin D, Selen),
- Vollgetreide, Fleisch, Eier, Milch und Käse (Zink),
- Rotwein, roter Traubensaft, Tee und Kakao (Polyphenole).
Neue Indikation für ACE-Hemmer?
Eine vielversprechende medikamentöse Option könnten ACE-Inhibitoren sein. In zahlreichen experimentellen Studien hat diese Substanzgruppe positive Effekte auf die Skelettmuskulatur bzw. auf Surrogatparameter gezeigt, die einen Einsatz bei Sarkopenie sinnvoll erscheinen lassen:
- Angiogenese (Wachstum von Blutgefäßen) und Verbesserung der Endothelfunktion in der Muskulatur,
- Zunahme der Mitochondrienzahl und der Konzentration anaboler Hormone,
- Dämpfung der Angiotensin-II-abhängigen Aktivierung inflammatorischer Mechanismen.
Darüber hinaus konnte in klinischen Beobachtungsstudien nachgewiesen werden, dass die Langzeiteinnahme von ACE-Hemmern bei älteren Menschen mit einer geringeren Abnahme der Muskelkraft und Ganggeschwindigkeit einhergeht. In einer anderen Untersuchung verbesserten ältere Menschen ihre Sechsminuten-Gehstrecke unter der Einnahme von ACE-Hemmern in vergleichbarem Maße wie eine Kontrollgruppe nach sechsmonatigem Training.
Literatur
[1] Cruz-Jentoft AJ, et al. Sarcopenia: European consensus on definition and diagnosis. Report of the European Working Group on Sarcopenia in Older People. Age Ageing 2010; 39: 412–423.
[2] Münzer T. Sarkopenie im Alter. Konzept, Klinik und Intervention. Schweiz Med Forum 2010; 10(10): 188–190.
[3] Püllen R. Sarkopenie. Muskulärer Abbau im höheren Lebensalter. Hessisches Ärzteblatt 2011; 7: 415–419.
[4] Püllen R, Zinke A. Malnutrition und Gebrechlichkeit (frailty) im höheren Lebensalter. Hessisches Ärzteblatt 2011; 5: 296–298.
[5] Bauer JM, et al. Malnutrition, Sarkopenie und Kachexie im Alter – von der Pathophysiologie zur Therapie. Ergebnisse eines internationalen Expertenmeetings der BANSS-Stiftung. Dtsch Med Wochenschr 2008; 133: 305–310.
[6] Fried LP, et al. Frailty in Older Adults: Evidence for a Phenotype. J Gerontol A Biol Sci Med Sci 2001; 56(3): M146–156.
[7] Gschwind YJ, Kressig RW. Der Stellenwert körperlicher Aktivität im Rahmen der Prävention von Sarkopenie und Frailty. Schweiz Z Ernährungsmed 2009; 4: 32–36.
[8] Kemmler W, Engelke K, von Stengel S. Effects of Whole-Body-Electromyostimulation on Sarcopenia in Lean, Elderly Sedentary Women. The TEST-III Study. Dtsch Z Sportmed 63 (2012) 343–350.
[9] Volkert D. Die Rolle der Ernährung zur Prävention von Sarkopenie und Frailty. Schweiz Z Ernährungsmed 2009; 4: 25–30.
[10] Norman K, et al. Bedeutung der Proteinzufuhr bei der Entstehung und Behandlung der Sarkopenie. Aktuel Ernährungsmed 2009; 34(4): 171–177.
[11] Maggio M, et al. Relation of Angiotensin-Converting Enzyme Inhibitor Treatment to Insulin-Like Growth Factor-1 Serum Levels in Subjects > 65 Years of Age (the InCHIANTI Study). Am J Cardiol 2006; 97(10): 1525–1529.
[12] Sharma S, et al. Angiotensin-Converting Enzyme (ACE) Inhibitors and Sarcopenia. JK Science 2012; 14(2): 105–106.



















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.