
- DAZ.online
- DAZ / AZ
- DAZ 37/2013
- Besser vernetzen
DAZ aktuell
Besser vernetzen
2. Jahrestagung House of Pharma
Forschung könne heute nur vernetzt erfolgreich sein – davon zeigte sich Prof. Dr. Manfred Schubert-Zsilavecz, neben Prof. Dr. Dr. Gerd Geisslinger einer der Initiatoren des House of Pharma, überzeugt. So habe es sich als erfolgreich erwiesen, auch außer-
universitäre Einrichtungen einzubinden, beispielsweise das Helmholtz-Zentrum oder Institute der Fraunhofer Gesellschaft. Forschung solle kein Selbstzweck sein, letztlich gehe es darum, Arzneimittel zur Heilung und Linderung von Krankheiten zu finden. Die Idee des House of Pharma sehe er als realisierbar an, wenn Partnerschaften mit weiteren Universitäten geschlossen würden.
Unterstützt wird die Idee des House of Pharma auch durch die Politik, wie das Grußwort des Hessischen Ministerpräsidenten Volker Bouffier zeigte. Er begrüße die Idee, dass sich Hochschule und Industrie besser vernetzen wollen. Das Konzept sei: Hochschule und Wirtschaft unter ein Dach zu bringen. Bereits bestehende House-of-Konzepte wie beispielsweise House of Logistics and Mobility oder House of Finance seien Vorreiter und Vorbild dafür, dass dies gelingen könne. Die Hochschule müsse „raus aus dem Elfenbeinturm“. Man müsse ein Klima für gemeinsame Forschung und Ertrag schaffen. Es komme auf das Miteinander an, denn, so Bouffier: „In der Grundlagenforschung ist die Hochschule besser, in der Anwendungsforschung dagegen die Industrie.“ Nicht zuletzt geht es Bouffier auch um die Stärkung des Standorts Hessen. So habe er Anfang dieses Jahres die „Initiative Gesundheitsindustrie Hessen“ ins Leben gerufen, die dazu beitragen soll, „die Arbeitsplätze in Hessen zu sichern, neue, hochqualifizierte Arbeitsplätze zu schaffen und die Attraktivität von Investitionen in Forschung, Entwicklung und Produktion zu steigern“.
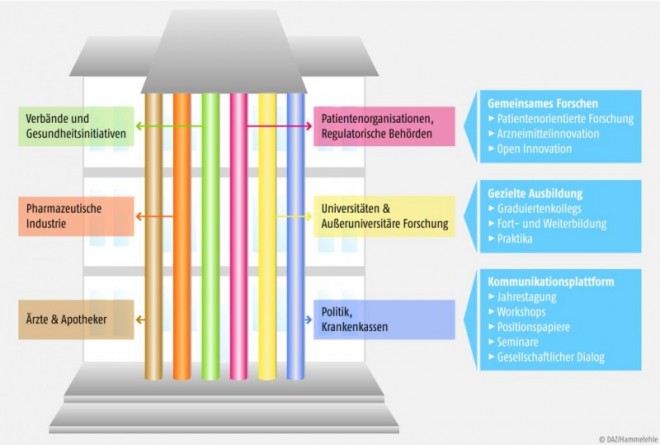
Das House of Pharma nimmt Gestalt an
Die Pharmaindustrie hat von ihrem einstigen Glanz verloren, heute dominieren oft negative Schlagzeilen, beklagte Professor Gerd Geisslinger, Goethe-Universität Frankfurt. Hinzu kommt, dass Arzneimittel in der Gesetzlichen Krankenversicherung meist als Kostentreiber wahrgenommen werden. In den Hintergrund tritt dabei, dass Arzneimittel das Gesundheits-, Renten- und Pflegesystem entlasten, die Zeit der Arbeitsunfähigkeit senken, zu mehr Lebensqualität beitragen sowie Arbeitsplätze in Forschung und Entwicklung schaffen. Weltweit werden, so Geisslinger, 603 Milliarden Dollar für F&E ausgegeben. Allerdings, trotz dieser Anstrengungen finden sich heute unter den Top Ten der innovativsten Unternehmen keine Pharmaunternehmen mehr. Man stellt hier eine Innovationslücke fest, die u.a. auf die immens gestiegenen Kosten und gesetzlichen Anforderungen zurückzuführen ist. Von 25 Substanzen, die es in die Präklinik schaffen, nimmt nur eine die Zulassungshürde. Die Entwicklungskosten pro Molekül steigen rapide an. Während sie in den Jahren 2002 bis 2006 bei etwa 2,8 Milliarden Dollar lagen, so sind sie in den Jahren 2007 bis 2012 bereits auf 4,2 Milliarden angestiegen. Und trotzdem: die F&E-Produktivität stagniert seit Jahren. Hier ist, so Geisslinger, Handlungsbedarf zu erkennen. Es müsse eine gemeinsame Strategie erarbeitet werden, die alle Beteiligten (Wissenschaft, Wirtschaft, Politik, Verbände, Krankenkassen, Patientenorganisationen etc.) zusammenführt, um die zu erwartenden Synergiepotenziale zu nutzen. Das House of Pharma will diese Vernetzung ermöglichen. Als Ziele der Interessengruppen adressiert das House of Pharma drei Handlungsfelder:
- Ausbildung hochqualifizierter Mitarbeiter (Ausbildung von Spitzenkräften, Fort- und Weiterbildung, Ausbau der strukturierten Doktorandenausbildung),
- Förderung von vernetzter, zukunftsorientierter Forschung (z.B. Ermöglichung von Arzneimittelinnovationen durch patientenorientierte Forschung, Sicherstellung eines effizienten Transfers zwischen Universität und Anwendung, Akquisition von Fördergeldern, Einbeziehung von Pharmakoökonomie),
- unabhängige und neutrale Diskussionsplattform (z.B. für gemeinsame Lösungswege für Probleme des Gesundheitssystems).
Dabei müsse der Patient im Fokus stehen: Es gehe darum, innovative und bezahlbare Arzneimittel zu entwickeln. Wie Geisslinger betonte, bestehe beim House of Pharma ein wesentlicher Unterschied zu anderen Pharma Clustern darin, dass es nicht von einem Unternehmen ausgeht, sondern von der Wissenschaft.
Als nächsten Schritt zum Ausbau des House of Pharma (HoP) kündigte Geisslinger die Gründungsinitiative HoP als eingetragenen Verein (e.V.) an. Es soll ein Projektmanager eingesetzt werden, der die Themen inhaltlich vorantreiben, Handlungsfelder ausarbeiten und Projekte definieren soll. Außerdem wird die nötige Infrastruktur wie beispielsweise eine Homepage aufgebaut. Darüber hinaus ist geplant, ein Büro an einem neutralen Ort zu beziehen (z.B. am Frankfurter Innovationszentrum FIZ).
Mehr Planbarkeit
Zur Einführung in die Diskussionsrunde über das Arzneimittelmarktneuordnungsgesetz (AMNOG) befasste sich Jeremy Morgan, Geschäftsführer der Lilly Deutschland GmbH, mit der Frage, was Pharmaunternehmen von der Politik erwarten. Aus seiner Perspektive steht hier eine bessere Planbarkeit an erster Stelle. Ständig neue Spargesetze förderten nicht die Investitionsbereitschaft der Industrie. Neben einem Mehr an Planbarkeit wünsche man sich darüber hinaus ein faires Preisbildungssystem, transparente Regelwerke und ein gutes Steuersystem. Die Politik kann im Gegenzug dafür von der Industrie innovative und bezahlbare Arzneimittel erwarten. Für ein besseres gegenseitiges Verständnis zwischen Politik und Industrie schlug er ein „Memorandum of Understanding“, wie es beispielsweise in Australien erarbeitet wurde, vor.
In der sich anschließenden Diskussion über die Auswirkungen des AMNOG betrachteten Birgit Fischer (Hauptgeschäftsführerin des Verbands der forschenden Pharma-Unternehmen vfa), Dr. Christoph Straub (Vorstandsvorsitzender der Barmer GEK) und Alexander Würfel (Sprecher der Geschäftsführung der Abbvie Deutschland) unter Moderation von Professor Schubert- Zsilavecz vor allem die Kosten-Nutzen-Bewertung. Die Industrieseite beklagte, dass dabei nicht in erster Linie der wissenschaftliche Aspekt der Nutzenbewertung, der Wert der Innovation im Mittelpunkt stehe, sondern die Kostensenkung. Dass es beim Verfahren der Kosten-Nutzen-Bewertung durchaus Verbesserungsmöglichkeiten gebe, räumte auch die Krankenkassenseite ein. Er sehe allerdings nicht, so der Barmer-Chef, dass Patienten durch das AMNOG nur mit Verzögerung in den Genuss neuer Therapiemöglichkeiten kämen oder ihnen neue Therapien sogar vorenthalten würden. Es sei darüber hinaus nicht damit getan, die derzeitigen Milliarden-Rücklagen der Krankenkassen für neue Arzneimittel auszugeben. Man könnte mit dem Geld auch den Innovationsstau im Krankenhausbereich beseitigen – und das Geld wäre weg. Vor diesem Hintergrund sprach sich der Vertreter der Krankenkasse dafür aus, die AMNOG-Regelungen weiterzuentwickeln und angemessene Maßnahmen zur Lösung der Probleme im Gesundheitswesen zu finden.
Vernetztes Forschen
Im Fokus einer weiteren Diskussionsrunde auf der Jahrestagung des House of Pharma stand das Thema vernetztes Forschen in Europa. Der Schwerpunkt lag dabei auf dem Rahmenprogramm für Forschung und Innovation der Europäischen Union: Horizon 2020. Unter der Moderation von Wolfgang van den Bergh, Chefredakteur der Ärzte Zeitung, befassten sich mit diesem Thema Susanne Burger (Unterabteilungsleiterin Europa im Bundesministerium für Bildung und Forschung), Dr. Hans-Otto Feldhütter (Hauptabteilungsleiter Forschung, Fraunhofer-Gesellschaft), Prof. Dr. Jochen Maas (Geschäftsführer F&E bei Sanofi Aventis), em. Prof. Dr. Christian Noe (Universität Wien), Dr. Jörg Schüttrumpf (Geschäftsbereichsleiter bei Biotest) und Dr. Rudolf Strohmeier (stv. Generaldirektor Forschung und Innovation der Europäischen Kommission). Insgesamt legt das Förderprogramm Horizon rund 80 Milliarden Euro auf, von denen etwa 10 bis 15 Prozent für den Bereich Gesundheit reserviert sind. Ziel ist es, Innovationen zu fördern, Wachstum und Arbeitsplätze in Europa zu schaffen. Das Programm setze vor allem auf interdisziplinäre Verknüpfung zwischen Forschungseinrichtungen der Industrie, aber auch die Zusammenarbeit zwischen Universitäten und Industrie soll dadurch verbessert und Berührungsängste abgebaut werden. Es sollten Projektteams zwischen beiden gebildet werden, die von Anfang an bei bestimmten Aufgabenstellungen zusammenarbeiten. Die Vernetzung in der Pharmaforschung, so Feldhütter, sei anspruchsvoller als in anderen Gebieten. Von guten Erfahrungen mit dem Projekt IMI (Innovative Medicines Initiative), eine Kooperation zwischen der Europäischen Union und dem europäischen Verband der pharmazeutischen Industrie (EFPIA), berichtete Noe. Hier konnten große Pharmaunternehmen für spezielle Projekte zusammengeführt werden. Die Diskutanten betonten, dass Förderprojekte auch dazu beitragen könnten, Schlüsseltechnologien auszuprobieren.
Wem gehören die Daten?
Wem gehören die Daten aus der klinischen Prüfung? Und in diesem Zusammenhang die Fragen: Müssen alle Daten einer klinischen Prüfung und müssen alle Studien, auch die mit negativem Ausgang, veröffentlicht werden? Darüber diskutierten Peter Albiez (Geschäftsführer bei Pfizer Pharma GmbH), Dr. Wolfgang Bolten (Präsident der Rheuma-Liga Hessen), Prof. Dr. Dr. h.c. Wolfgang Huber (Bischof a.D. und Mitglied im Deutschen Ethikrat), Dr. Wolfgang Rehmann (Kanzlei Taylor Wessing) und Dr. Wolfgang Schwerdtfeger (Präsident des Bundesinstituts für Arzneimittel und Medizinprodukte). Die Pharmaindustrie bezahlt die klinischen Studien, also gehören ihr die dadurch gewonnenen Daten – so einfach lässt sich diese Frage nicht lösen. Denn auch der Proband, der Patient, der an Studien teilnimmt, hat ein Recht an seinen Daten (Eigentumsvorbehalt). Er kann jedoch aus Gründen des Patientennutzens, der Solidarität und des Gemeinwohls auf seinen Eigentumsvorbehalt verzichten. Hier heißt es Vertrauen schaffen. Ein rechtlich klarer Rahmen lässt sich durch zu unterschreibende Einverständniserklärungen der Patienten schaffen.
Unternehmen starteten bereits 2005 eine Initiative, sämtliche Studien zu veröffentlichen. Hier sind allerdings noch Standards und ein verbindlicher Rahmen zu schaffen, welche Daten veröffentlicht werden sollten. Und: Die Daten sollten auch zugänglich sein. In Norwegen, Schweden und Großbritannien beispielsweise können Studiendaten öffentlich im Internet eingesehen werden. Immerhin, auch das deutsche Arzneimittelgesetz bestimmt in § 42 b, dass pharmazeutische Unternehmer Berichte über alle Ergebnisse konfirmatorischer klinischer Prüfungen zum Nachweis der Wirksamkeit und Unbedenklichkeit, unabhängig
davon, ob sie günstig oder ungünstig sind, der zuständigen Bundesoberbehörde zur Eingabe in die Datenbank nach § 67a Absatz 2 zur Verfügung stellen müssen. Die Veröffentlichung erfolgt beim PharmNet.Bund (www.pharmanet-bund.de). Allerdings sind hiervon nicht die Rohdaten einer Studie betroffen, die laut eines europäischen Gerichts nicht herausgegeben werden müssen. Berücksichtigt werden muss bei diesen Fragen allerdings auch das Interesse des Unternehmens (Unterlagenschutz). Fazit: Noch sind nicht alle Fragen zur Veröffentlichung von Studiendaten geklärt. Daher soll eine eigene Verordnung dazu in der nächsten Zeit Klarheit bringen.


























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.