
- DAZ.online
- DAZ / AZ
- DAZ 15/2013
- Von der Rachitis-...
Update Vitamin D
Von der Rachitis-Prophylaxe zur allgemeinen Gesundheitsvorsorge
Vom Sonnenvitamin zum Sonnenhormon
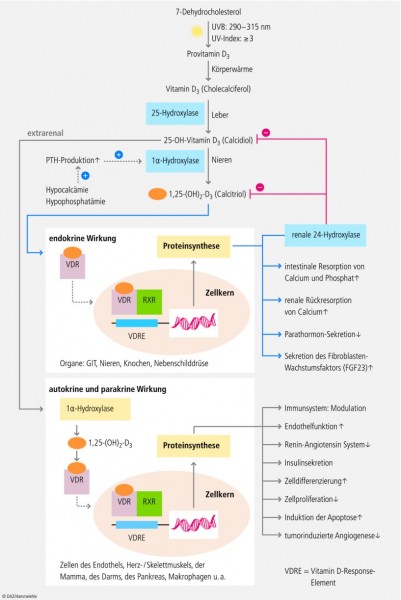
Vitamin D – das Sonnenvitamin – wird mithilfe des Sonnenlichts (UV-B: 290 bis 315 nm) in der Haut aus der Vorstufe 7-Dehydrocholesterin (7-DHC) über die Zwischenstufe Provitamin D3 gebildet. Provitamin D3 wird durch Körperwärme in Vitamin D3 (Cholecalciferol) umgewandelt. Bei exzessiver Sonnenlicht-Exposition werden Provitamin D3 und Vitamin D3 in inaktive Photoprodukte abgebaut, so dass eine übermäßige Bildung des Sonnenvitamins in der Haut verhindert wird. Die Leber wandelt Vitamin D3 über das mitochondriale Enzym 25-Hydroxylase (25-OHase) in 25-Hydroxy-Vitamin D (25-OH-D, Calcidiol) um. 25-OH-D im Serum (ng/ml oder nmol/l) ist das Barometer zur labormedizinischen Beurteilung des Vitamin-D-Status [1 – 3]. 25-OH-D wird danach in den Nieren über das Enzym 1-alpha-Hydroxylase (1-OHase) in das stoffwechselaktive Vitamin-D-Hormon (1,25-(OH)2-D) umgewandelt. Man bezeichnet dieses Enzym auch als renale 1-alpha-Hydroxylase – da es in der Niere vorkommt (→ endokrine Wirkung). Neben den Nieren besitzen die meisten anderen Zell- und Organsysteme eine lokale 1-alpha-Hydroxylase (1-OHase). Diese Zellen können in Abhängigkeit von der 25-OH-D-Verfügbarkeit und dem Bedarf das biologisch aktive Vitamin-D-Hormon mithilfe ihrer lokalen 1-OHase selber bilden (→ autokrine und parakrine Wirkung). 1,25-(OH)2-D gehört, wie auch die Sexualhormone (z. B. Estradiol) oder die Corticosteroide (z. B. Cortison) zu den Steroidhormonen [2, 4].
Über einen Feedback-Mechanismus reguliert der 1,25-(OH)2-D-Spiegel zum einen die Synthese von 1,25-(OH)2-D und reduziert zum anderen die Synthese und Sekretion des Parathormons in der Nebenschilddrüse (Abb. 1). 1,25-(OH)2-D erhöht die Expression der 24-Hydroxylase (24-OHase), die das Vitamin-D-Hormon in die wasserlösliche biologisch inaktive calcitroische Säure abbaut, welche biliär ausgeschieden wird [1].
Das Barometer der Vitamin-D-Gesundheit: 25-OH-Vitamin D
Der 25-OH-D-Spiegel im Serum sollte zwischen 30 bis 60 ng/ml liegen, um langfristig negative Folgen auf die Gesundheit zu vermeiden. Ideal ist ein 25-OH-D-Status zwischen 40 bis 60 ng/ml bzw. 100 bis 150 nmol/l. Bei 25-OH-D-Spiegeln unter 20 ng/ml liegt ein ausgeprägter Vitamin-D-Mangel und bei Werten zwischen 21 bis 29 ng/ml ein mäßiger Vitamin-D-Mangel vor, der auch als Vitamin-D-Insuffizienz bezeichnet wird. Eine Vitamin-D-Intoxikation ist erst ab Werten von 25-OH-D > 150 ng/ml zu erwarten. Zur Vermeidung eines Anstiegs des Parathormon-(PTH)-Spiegels sind 25-OH-D-Werte von ≥ 40 ng/ml bzw. 100 nmol/l notwendig [1, 3, 4]. Allerdings konnte in einer kürzlich publizierten Analyse von mehr als 312.962 gepaarten PTH- und 25-OH-D-Spiegeln kein Schwellenwert des 25-OH-D-abhängigen Parathormon-Status beobachtet werden, bei dem eine Steigerung des 25-OH-D-Wertes den PTH-Anstieg supprimiert, sogar bei 25-OH-D-Spiegeln > 60 ng/ml. Bemerkenswert bei dieser Analyse war der hohe Anteil an Blutproben, die einen Vitamin-D-Mangel und sekundären Hyperparathyreoidismus anzeigten [11]. Das aktive 1,25-(OH)2-D sollte zur Einschätzung des Vitamin-D-Status nicht gemessen werden, da es bei einem Vitamin-D-Mangel oft aufgrund erhöhter Parathormonspiegel normal oder sogar kompensatorisch erhöht ist!
Nördlich des 35° Breitengrades steht von Oktober bis März die Sonne nicht hoch genug am Himmel, um unsere Haut mit den notwendigen UV-B-Strahlen von 290 bis 315 nm zu versorgen. Das erklärt auch, warum so viele Menschen gerade in den Wintermonaten von einem Vitamin-D-Mangel (25-OH-D < 20 ng/ml bzw. 50 nmol/l) betroffen sind. Auch der UV-Index kann zur Einschätzung der sonnenabhängigen Vitamin-D-Bildung in der Haut herangezogen werden. Bei einem UV-Index < 3 ist keine Vitamin-D-Synthese über die Haut möglich [2, 3]. Die Vitamin-D-Zufuhr über die Ernährung spielt nur eine untergeordnete Rolle für die Vitamin-D-Versorgung [1, 2]. Weltweit sind ca. eine Milliarde Menschen von einem Vitamin-D-Mangel (25-OH-D < 20 ng/ml) oder einer Vitamin-D-Insuffizienz (25-OH-D 21 bis 29 ng/ml) betroffen [12].
Gesundheitsrisiko: Vitamin-D-Mangel
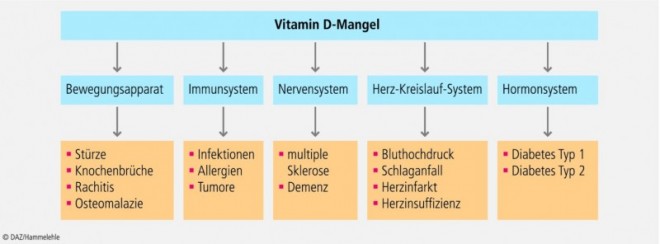
Ein Vitamin-D-Mangel (25-OH-D im Serum < 20 ng/ml) gilt als ein wichtiger ätiologischer Faktor bei der Pathogenese chronischer Erkrankungen. Dazu gehören Autoimmunerkrankungen (z. B. multiple Sklerose, Typ-1-Diabetes), entzündliche Darmerkrankungen (z. B. Morbus Crohn), Infektionen (z. B. Infektionen der oberen Atemwege), Immunschwäche, kardiovaskuläre Erkrankungen (z. B. Bluthochdruck, Herzinsuffizienz), Krebserkrankungen und neurokognitive Erkrankungen (z. B. Morbus Alzheimer) [4–9] (Abb. 2).
Die aktuellen Ergebnisse der ESTHER-Studie, einer landesweiten Kohortenstudie aus dem Saarland an etwa 10.000 Frauen und Männern im Alter von 50 bis 74 Jahren, bei denen der 25-OH-D-Status erfasst wurde, zeigen im Follow-up von median 9,5 Jahren, dass ein Vitamin-D-Mangel signifikant die allgemeine und kardiovaskuläre Mortalität erhöht. Ein Vitamin-D-Mangel war zusätzlich assoziiert mit einer signifikant erhöhten Krebsmortalität und einer erhöhten Mortalität bei respiratorischen Erkrankungen [10].
Knochen- und Muskelstoffwechsel: Fraktur- und Sturzrisiko
Ein schwerer Vitamin-D-Mangel (25-OH-D < 10 ng/ml) führt bei Kindern zu Rachitis und bei Erwachsenen zu einer Osteomalazie. Klinisch gehört neben einer Mineralisationsstörung eine proximal betonte Myopathie, die sich in Muskelschwäche und -schmerzen äußern kann, zu den Symptomen eines schweren Vitamin-D-Mangels. Bei älteren Erwachsenen führt ein Mangel an Vitamin D zu einem erhöhten Sturz- und Frakturrisiko.
In der im Juli 2012 im New England Journal of Medicine von Bischoff-Ferrari publizierten Metaanalyse wurden die Originaldaten von 30.011 Studienteilnehmern aus elf doppelblinden und randomisierten Studien gepoolt. Die klassische Intention-to-Treat-Analyse zeigte eine statistisch nicht signifikante Reduktion der Hüftfrakturen um 10%. Wenn man jedoch den Effekt in Abhängigkeit von der tatsächlich eingenommenen Vitamin-D-Menge untersuchte, dann zeigt sich in der Gruppe mit der höchsten Dosierung (792 bis 2000 I.E. Vitamin D/Tag) eine statistisch signifikante Reduktion der Hüftfrakturen um 30%, verglichen mit der Kontrollgruppe. Bei jenen Personen, die pro Tag weniger als 792 I.E. Vitamin D supplementierten, war keine statistisch signifikante Reduktion der Hüftfrakturen erkennbar. Eine vergleichbare Dosis-Wirkungs-Abhängigkeit war für alle nicht-vertebralen Frakturen nachweisbar. Die Subgruppenanalyse zeigte in allen Altersgruppen, bei zu Hause lebenden Senioren und bei Senioren im Pflegeheim mit der höchsten Vitamin-D-Dosierung eine signifikante Reduktion der Frakturen [13].
Neben einer positiven Wirkung auf die Knochendichte hat Vitamin D einen unmittelbaren stärkenden Effekt auf die Muskulatur, was neben einer Begünstigung des Calciumeinstroms in die Muskelzelle durch eine rezeptorvermittelte Stimulation der Muskelproteinsynthese erklärt wird [14, 15]. Möglicherweise ist dieser Zusatzeffekt für die Frakturreduktion unter Vitamin-D-Supplementierung entscheidend, da Stürze der primäre Risikofaktor für Frakturen sind. Dies untermauern auch Studienergebnisse, wonach es bereits nach zwei bis drei Monaten der Supplementierung von Vitamin D zu einer signifikanten Reduktion des Sturzrisikos kommt, die Muskulatur also sehr schnell auf eine Vitamin-D-Zufuhr reagiert, und dass sich die Frakturreduktion bereits nach etwa sechs Monaten bemerkbar macht [16].
KommentarDie 25-OH-D-Status orientierte Supplementierung von Vitamin D3 ist eine wichtige präventivmedizinische Strategie, um die Knochengesundheit in allen Altersstufen zu fördern sowie das Fraktur- und Sturzrisiko bei älteren Menschen zu vermindern. Die Supplementierung sollte sich im Hinblick auf die ossäre Wirkung und intestinale Calciumresorption an einem 25-OH-D-Status von ≥ 75 nmol/l bzw. ≥ 30 ng/ml orientieren, dies gilt insbesondere in der Pharmakotherapie der Osteoporose. |
Herz-Kreislauf-System: Bluthochdruck und Herzinsuffizienz
Ein Mangel an Vitamin D (25-OH-D < 20 ng/ml bzw. 50 nmol/l)) steigert signifikant die allgemeine und die kardiovaskuläre Mortalität [17]. In der Intermountain Heart Collaborative Study, einer prospektiven Studie mit 41.504 Teilnehmern, konnte bei 63,6% eine unzureichende Vitamin-D-Versorgung (25-OH-D: < 30 ng/ml) nachgewiesen werden. Ein 25-OH-D-Spiegel von < 15 ng/ml im Vergleich zu einem 25-OH-D-Spiegel > 30 ng/ml war mit einem hoch signifikanten Anstieg der Prävalenz für Typ-2-Diabetes, Bluthochdruck, Dyslipoproteinämie, koronare Herzkrankheit, Myokardinfarkt, Herzinsuffizienz und Schlaganfall assoziiert, auch die Inzidenz der allgemeinen Mortalität war erhöht [18, 19].
Ein systematischer Review und eine Metaanalyse kommen zu dem Schluss, dass Vitamin D den systolischen Blutdruck um - 6,18 mmHg und den diastolischen Blutdruck um - 3,1 mmHg bei Hypertonikern senkt. Keine Veränderung des Blutdrucks konnte bei Normotonikern beobachtet werden [20]. Schwarze US-Amerikaner leiden signifikant häufiger unter hohem Blutdruck als weiße. Eine geringere Bildung von Vitamin D könnte dafür mitverantwortlich sein, da Menschen mit dunkler Hautfarbe aufgrund des höheren Melanin-Gehaltes generell weniger Vitamin D in der Haut produzieren und somit niedrigere Spiegel an 25-OH-D aufweisen. Eine aktuelle vierarmige, doppelblinde, placebokontrollierte und randomisierte Studie an 283 Schwarzen (Alter: ± 51 Jahre) untersuchte den Einfluss von 1000 I.E., 2000 I.E. und 4000 I.E. Vitamin D3 pro Tag oder Placebo über einen Zeitraum von drei Monaten auf den Blutdruck. Es wurde der 25-OH-D-Spiegel erfasst und zu Beginn, nach drei und sechs Monaten der Blutdruck gemessen. Der Unterschied zwischen dem systolischen Blutdruck zu Studienbeginn und nach drei Monaten in der Placebo-Gruppe betrug +1,7 mmHg, in der Gruppe mit 1000 I.E. Vitamin D3 - 0,66 mmHg, mit 2000 I.E. Vitamin D - 3,44 mg Hg und in der Gruppe mit 4000 I.E. Vitamin D3 pro Tag - 4,0 mmHg. Pro Anstieg des 25-OH-D-Spiegels um 1 ng/ml war eine signifikante Reduktion des systolischen Blutdrucks um 0,2 mmHg nachweisbar. Es konnte keine signifikante Reduktion des diastolischen Blutdrucks nachgewiesen werden [21].
Die seit Langem bekannte Suppression von Parathormon (PTH) durch Vitamin D muss heute in neuem Licht betrachtet werden, seitdem in den letzten Jahren PTH zunehmend als ein wichtiger Risikofaktor für kardiovaskuläre Erkrankungen erkannt wurde. Parathormon kann auf verschiedenen Ebenen direkt oder indirekt das Herz-Kreislauf-System schädigen. Erhöhte PTH-Spiegel sowie eine Hyperkalzämie können die Entwicklung einer Hypertonie fördern. Darüber hinaus ist ein Hyperparathyreoidismus mit einer gehäuften Inzidenz der Hyperkontraktilität des Herzmuskels mit konsekutiver linksventrikulärer Hypertrophie sowie mit Kalzifizierung des Myokards assoziiert. Vitamin D wirkt diesen Prozessen entgegen, indem es u. a. die Synthese antiinflammatorischer Zytokine und anderer Substanzen fördert, die eine Gefäßkalzifizierung verringern.
KommentarNach den bisher vorliegenden Daten aus epidemiologischen und prospektiven Kohorten-Studien sowie kleineren Interventionsstudien sollte der Vitamin-D-Status beikardiovaskulären Erkrankungen grundsätzlich labordiagnostisch kontrolliert und entsprechend durch Supplementierung kompensiert werden. Die Normalisierung des 25-OH-D-Status könnte auch dazu beitragen den therapeutischen Bedarf an Antihypertonika und Kardiaka zu verringern. |
In einer placebokontrollierten Doppelblind-Studie an 80 Kleinkindern mit Herzinsuffizienz führte die tägliche Supplementierung von 1200 I. E. Vitamin D3 über zwölf Wochen bei 42 Kindern im Vergleich zu den 38 Kindern aus der Placebogruppe neben einem signifikanten Anstieg des 25-OH-D-Status (13,4 → 32,89 ng/ml) zu einer signifikanten Verbesserung der Herzmuskelleistung und Verringerung verschiedener kardiovaskulärer Risikoparameter [23].
Diabetologie
• Typ-1-Diabetes
In einer finnischen Kohortenstudie an 12.058 Kindern wurde der Einfluss der Gabe von Vitamin D im ersten Lebensjahr auf die Diabetesinzidenz über einen Zeitraum von 30 Jahren verfolgt. Dabei zeigte sich, dass Neugeborene, denen im ersten Lebensjahr täglich 2000 I. E. Vitamin D3 im Rahmen der Rachitis-Prophylaxe gegeben wurde, im Vergleich zu denjenigen mit geringer dosierten Supplementen ein 78% niedrigeres Risiko für Diabetes mellitus Typ 1 hatten. Kinder, bei denen im ersten Lebensjahr Rachitis auftrat, hatten im Vergleich zu nicht erkrankten Kindern ein dreifach höheres Risiko für Typ-1-Diabetes [24]. In einer Metaanalyse von vier Fall-Kontroll-Studien war das Risiko für Typ-1-Diabetes bei Säuglingen, die ein Vitamin-D-Supplement erhielten im Vergleich zu denen, die kein Vitamin D bekamen um 29% verringert [25]. Die Bedeutung des maternalen Vitamin-D-Status auf die spätere Entstehung von Typ-1-Diabetes beim Neugeborenen beschreibt eine norwegische Kohorten-Studie an 20.072 Frauen. Dabei war ein niedriger maternaler 25-OH-D-Status in der Schwangerschaft gegenüber einem guten 25-OH-D-Status (> 89 nmol/l bzw. 35,6 ng/ml) mit einem mehr als zweifach erhöhten Risiko verbunden, später einen Typ-1-Diabetes zu entwickeln [26].
• Typ-2-Diabetes und metabolisches Syndrom
In einer randomisierten, placebokontrollierten Studie mit insulinresistenten südasiatischen Frauen (Alter: 23 bis 68 Jahre), die im Median einen 25-OH-D-Ausgangswert von < 10 ng/ml aufwiesen, führte die tägliche Supplementierung von 4000 I.E. Vitamin D gegenüber Placebo zu einer signifikanten Verbesserung der Insulinsensitivität und Reduktion der Insulinresistenz. Die Insulinresistenz nahm insbesondere dann ab, wenn die 25-OH-D-Spiegel über 32 ng/ml (80 nmol/l) anstiegen [27].
In einer prospektiven Studie wurde die Assoziation des 25-OH-D-Spiegels mit der Inzidenz des metabolischen Syndroms bei 4164 australischen Erwachsenen (Alter ± 50 Jahre) untersucht. Dabei wurden von allen Studienteilnehmern neben dem Taillenumfang auch die klassischen Risikofaktoren des Metabolischen Syndroms erfasst. Nach fünf Jahren Follow-up beobachteten die Wissenschaftler bei den Studienteilnehmern mit einem 25-OH-D-Spiegel < 18 ng/ml und 18 bis 23 ng/ml eine signifikant erhöhte Wahrscheinlichkeit am metabolischen Syndrom zu erkranken im Vergleich zu denjenigen mit einem guten Vitamin-D-Status von > 34 ng/ml. Sie schlussfolgerten daraus, dass bei australischen Erwachsenen ein Vitamin-D-Mangel sowie eine Vitamin-D-Insuffizienz mit einem signifikant erhöhten Risiko für das metabolische Syndrom, Insulinresistenz, hohem Taillenumfang sowie erhöhten Glucose- und Triglyceridspiegeln assoziiert ist [28].
KommentarPatienten mit Diabetes mellitus, Insulinresistenz und metabolischem Syndrom scheinen nach der aktuellen Datenlage im Hinblick auf die metabolische Kontrolle, den Komorbiditäten und dem erhöhten Mortalitätsrisiko im besonderen Maße von der labordiagnostisch validierten Supplementierung von Vitamin D zu profitieren. |
Die Ergebnisse einer weiteren prospektiven Studie liefern Hinweise dafür, dass ein Vitamin-D-Mangel die Progression eines Prädiabetes zum manifesten Typ-2-Diabetes beschleunigt. Es wurden Glucosetoleranz und 25-OH-D-Spiegel von 980 Frauen und 1398 Männern (Alter: 35 bis 56 Jahre) untersucht, bei denen vor Studienbeginn kein Typ-2-Diabetes vorlag. Nach acht bis zehn Jahren Follow-up wurden die Studienteilnehmer mit Prädiabetes oder Typ-2-Diabetes mit alters- und geschlechtskorrelierten Kontrollen verglichen, die eine normale Glucosetoleranz aufwiesen. Nach Bereinigung von potenziellen Störvariablen hatten die männlichen Teilnehmer aus der höchsten Quartile gegenüber denjenigen aus der niedrigsten Quartile des 25-OH-D-Spiegels ein 48% verringertes Risiko für die Progression vom Prädiabetes zum Typ-2-Diabetes [29]. In einer soeben publizierten Interventionsstudie an 100 Typ-2-Diabetikern führte die orale Supplementierung von 50.000 I.E. Vitamin D3 /Woche über acht Wochen neben einem Anstieg der 25-OH-D-Werte zu einer signifikanten Verbesserung des HOMA-Index, der Insulinresistenz und der Nüchternglucosespiegel [49].
GENEXPRESSION
Bindeglied zwischen Vitamin D und PräventionIn einer aktuellen randomisierten placebokontrollierten Doppelblindstudie wurde nun erstmals der Einfluss einer Supplementierung von täglich 400 I.E. oder 2000 I.E. Vitamin D3 für zwei Monaten auf die Genexpression der weißen Blutkörperchen (Leukozyten) bei gesunden Erwachsenen im Winter untersucht. Dabei war die Verbesserung des 25-OH-D-Status mit einer mindestens 1,5-fachen Änderung der Genexpression in 291 Genen assoziiert. Die Ergebnisse dieser Studie lassen vermuten, dass jegliche Verbesserung des Vitamin-D-Status signifikant die Expression von Genen beeinflusst, die eine Vielzahl von biologischen Funktionen haben und in mehr als 160 Stoffwechselwegen verbunden sind mit der Pathogenese von Autoimmunerkrankungen, Krebserkrankungen und kardiovaskulären Erkrankungen. Diese Studie deckt zum ersten Mal genetische Fingerabdrücke auf, die auf molekularbiochemischer Ebene einen wichtigen Beitrag liefern könnten, um die nicht-skelettären Wirkungen des Sonnenvitamins auf die Gesundheit zu verstehen [50]. |
Immunsystem
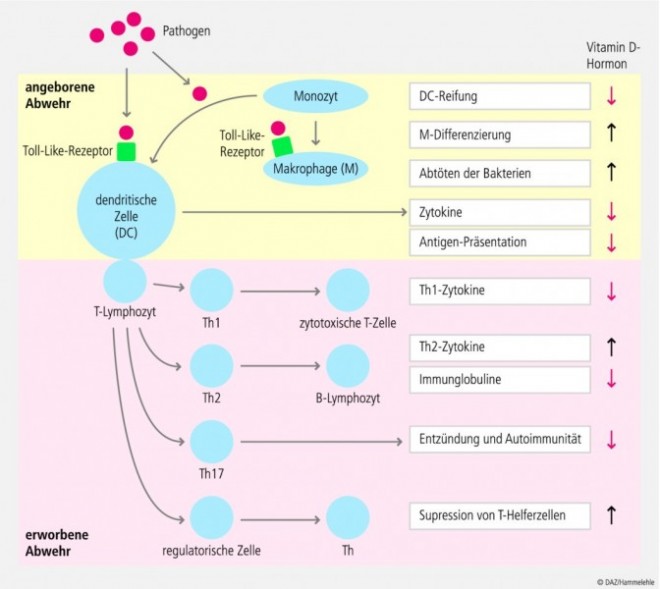
Neben den endokrinen Effekten übt Vitamin-D-Hormon auch auto- und parakrine Wirkungen aus. Zahlreiche Körperzellen, darunter auch immunkompetente Zellen wie dendritische Zellen, Makrophagen, B- und T-Lymphozyten, verfügen über den Vitamin-D-Rezeptor und die enzymatische Ausstattung zur Synthese von Calcitriol aus seinem Präkursor 25-OH-D. 1,25-(OH)2-D ist ein potenter Modulator der erworbenen Immunität und der Immunbalance zwischen Th1- und Th2-Zellen (Abb. 3). Lokal oder systemisch gebildetes Vitamin-D-Hormon inhibiert unter anderem die Reifung der dendritischen Zellen, reduziert die Th1-vermittelte Sekretion proinflammatorischer Zytokine wie TNF α, steigert die Differenzierung von Monozyten zu Makrophagen und deren Phagozytoserate sowie die Aktivität lysosomaler Enzyme in Makrophagen [22].
• Atemwegserkrankungen
Eine Reihe von Beobachtungs- und epidemiologischen Studien, unterstützt von Interventionsstudien und dem ubiquitären Nachweis des Vitamin-D-Rezeptors in allen wichtigen Organsystemen, zeigen eine Assoziation zwischen dem 25-OH-D-Spiegel und einer verminderten Inzidenz von Infektionen der oberen Atemwege [30]. In einer US-amerikanischen Studie an 18.883 Personen (Alter > zwölf Jahre) – repräsentativer Querschnitt der US-Bevölkerung – wurde der Zusammenhang zwischen dem 25-OH-D-Spiegel im Serum und der Anfälligkeit für Infekte der oberen Atemwege in Bezug auf die Jahreszeit untersucht. Dabei korrelierte der Vitamin-D-Status invers mit der Infektrate der oberen Atemwege: Gegenüber den Probanden mit einem normalen 25-OH-D-Status (≥ 30 ng/ml) hatten die Probanden mit einem insuffizienten Status (10 bis 30 ng/ml) eine 1,24-fach erhöhte Infektrate und die Probanden mit einem ausgeprägten Vitamin-D-Mangel (< 10 ng/ml) eine 1,36-fach erhöhte Infektrate. Bei Patienten mit Asthma bronchiale oder chronisch obstruktiver Lungenerkrankung (COPD) war die Infektrate sogar 2,26-fach bzw. 5,67-fach erhöht [31].
KommentarIm Hinblick auf die Vorbeugung von Atemwegsinfektionen können Kinder und Erwachsene anhand der Daten von Interventionsstudien von einer Normalisierung des Vitamin-D-Status profitieren. Weitere Interventionsstudien müssen in den nächsten Jahren zeigen, ob Patienten mit Asthma und COPD im Hinblick auf die Wirksamkeit der Medikation (z. B. Corticoide) und den Krankheitsverlauf auch von der Supplementierung von Vitamin D profitieren können. |
In einer randomisierten, placebokontrollierten Doppelblindstudie an 334 japanischen Schulkindern wurde der Einfluss von Vitamin D3 auf Atemwegserkrankungen wie Influenza A und Asthma untersucht. Die Kinder erhielten von Dezember 2008 bis März 2009 täglich ein Placebo oder 1200 I.E. Vitamin D3. Das Risiko, an Influenza A zu erkranken, wurde durch die Supplementierung von Vitamin D3 gegenüber Placebo um 64% verringert. Der protektive Effekt war insbesondere bei denjenigen Kindern ausgeprägt, die keine anderen Vitamin-D-haltigen Supplemente einnahmen. Noch beeindruckender war jedoch bei dieser Untersuchung das Ergebnis in Bezug auf die Asthmaanfallshäufigkeit: in der Vitamin-D-Gruppe reduzierte sich die Anfallshäufigkeit um 83% [32]. Auch in Interventionsstudien mit Erwachsenen führte die Supplementierung von Vitamin D3 zu einer signifikanten Reduktion der jahreszeitlich bedingten grippalen Infekte [33].
• Neurodermitis
Vitamin-D-Hormon besitzt eine ausgeprägte modulierende Wirkung auf die Balance zwischen den Th1- und Th-2-Zellen. Störungen in der Th1:Th2-Balance spielen neben Autoimmunerkrankungen wie multiple Sklerose auch bei atopischen Erkrankungen eine pathogenetische Rolle. In zwei randomisierten placebokontrollierten Doppelblindstudien führte die Supplementierung von Vitamin D allein (1600 I.E./Tag, p.o.) als auch in der Kombination mit Vitamin E (600 I.E./Tag, p.o.) über einen Zeitraum von 60 Tagen zu einer signifikanten Verbesserung des Hautbildes bei Patienten (Alter: 13 bis 45 Jahre) mit milder, moderater und schwerer atopischer Dermatitis. Bei atopischer Dermatitis sind die entzündlichen Prozesse in der Haut mit einer intensiven Infiltration von Lymphozyten und Eosinophilen assoziiert, die proinflammatorische Zytokine, Superoxid-Radikale, Hydrogenperoxide und Peroxynitrit freisetzen. Bemerkenswerterweise konnte in diesen Studien nachgewiesen werden, dass nicht nur Vitamin E sondern auch Vitamin D die oxidative Belastung und entzündlichen Prozesse in der Haut senkt sowie die Aktivität der erythrozytären Superoxid-Dismutase signifikant erhöht [34 – 36].
Krebserkrankungen
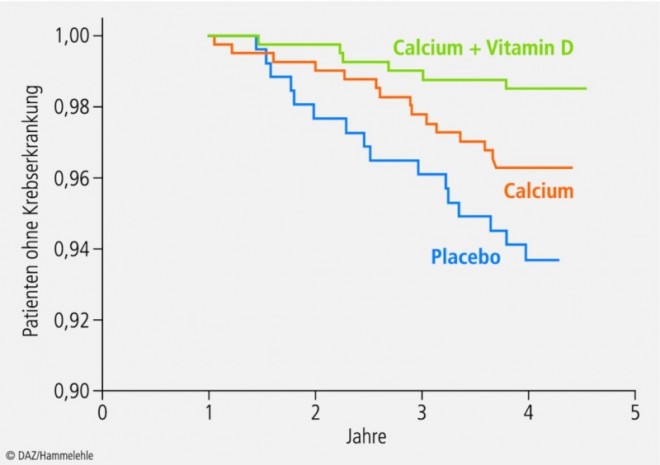
Vitamin-D-Mangel findet sich häufig bei Krebspatienten und korreliert mit der Krankheitsprogression. In Beobachtungsstudien ist ein Vitamin-D-Mangel mit dem vermehrten Auftreten von Brust- und Dickdarmkrebs sowie mit einem ungünstigen Verlauf von Non-Hodgkin-Lymphomen assoziiert [37 – 39]. In einer placebokontrollierten Doppelblindstudie an 1179 postmenopausalen Frauen im Alter von über 55 Jahren wurde der Einfluss von täglich 1400 mg Calcium, der Kombination von 1400 mg Calcium und 1100 I.E. Vitamin D oder Placebo auf das Krebsrisiko über einen Zeitraum von vier Jahren erfasst. Unter der Kombination von Calcium und Vitamin D stieg der 25-OH-D-Spiegel von 28,7 ng/ml auf 38,4 ng/ml an. In den beiden anderen Gruppen blieb der Vitamin-D-Status unverändert. Nach vier Jahren war im Vergleich zur Placebo-Gruppe das relative Risiko an Krebs zu erkranken in der Calcium+Vitamin-D-Gruppe um 60% reduziert, in der Calcium-Gruppe allein um 47%. Eine erneute Auswertung zum krebsfreien Überleben nach zwölf Monaten zeigte, dass das relative Risiko in der Calcium+Vitamin-D-Gruppe sogar signifikant um 77% reduziert worden war (Abb. 4). Die Werte in der Calcium-Gruppe blieben allerdings nahezu unverändert [33].
In einer prospektiven Kohorten-Studie beobachteten kanadische Wissenschaftler den Krankheitsverlauf von 512 Frauen mit Brustkrebs etwa zwölf Jahre lang, von 1997 bis 2008. Das Durchschnittsalter betrug bei Diagnosestellung 50,4 Jahre. 37,5% der Patientinnen hatten bei Diagnosestellung einen Vitamin-D-Mangel. Nur 24% der Frauen hatten einen fast normalen Vitamin-D-Status (25-OH-D > 29 ng/ml bzw. 72 nmol/l). Ein Vitamin-D-Mangel war mit dem Auftreten aggressiverer Brustkrebsformen verbunden. Nach zwölf Jahren war bei Frauen mit einem Vitamin-D-Mangel das Risiko für eine Metastasierung gegenüber denjenigen mit normalem Vitamin-D-Status um 94% erhöht [41].
KommentarDer Vitamin-D-Status sollte bei allen Krebspatienten (25-OH-D, Serum) kontrolliert und durch adäquate Supplementierung kompensiert werden (25-OH-D-Zielwert: 40 bis 60 ng/ml bzw. 100 bis 150 nmol). Dies gilt insbesondere für Krebspatienten mit schlechtem Ernährungsstatus, Therapien mit Anthrazyklin- und Taxan-haltigen Chemotherapien sowie bei muskulären, mukokutanen Störungen, Fatigue und Tumorkachexie. |
Bei Brustkrebspatientinnen konnte unter einer Anthrazyklin- und Taxan-haltigen Polychemotherapie ein deutlicher Abfall des 25-OH-D-Spiegels beobachtet werden [42]. Einige Zytostatika (z. B. Cyclophosphamid, Paclitaxel) sind Liganden des Pregnan-X-Rezeptors und können dadurch über die Induktion der 24-Hydroxylase den enzymatischen Abbau von 25-OH-D und 1,25-(OH)2-D im Verlauf der Chemotherapie steigern [43, 47]. Docetaxel ist ein bekannter Auslöser kutaner Nebenwirkungen und Geschmacksstörungen. Ein Vitamin-D-Mangel kann das Auftreten einer Chemotherapie-induzierten Mukositis und Dysgeusie begünstigen. In Fallberichten konnten mukokutane Nebenwirkungen (z. B. Stomatitis) und Geschmacksstörungen, die bei Krebspatienten unter einer Polychemotherapie (Docetaxel, Carboplatin und Trastuzumab) oder FOLFOX6 auftraten, erfolgreich durch die Supplementierung von Vitamin D3 behandelt werden [44]. Auch Arthralgien und Fatigue unter der Therapie mit Aromatasehemmern wie Letrozol konnten durch die labordiagnostisch validierte Supplementierung von Vitamin D (z. B. 50.000 I.E. Vitamin D/Woche für zwölf Wochen, p. o.) bei Brustkrebspatientinnen mit Vitamin-D-Mangel deutlich gelindert werden [45, 46]. Ähnliche Ergebnisse liegen zum Einsatz von Bisphosphonaten vor. Die ossäre Wirksamkeit der Bisphosphonate wird bei einem adäquaten Vitamin-D-Status (25-OH-D ≥ 33 ng/ml) verbessert. Dies könnte damit zusammenhängen, dass erst ab einem 25-OH-D-Spiegel von ≥ 40 ng/ml kein Anstieg der Parathormonspiegel mehr nachweisbar ist [2, 4].
Arzneimittel und Vitamin D
Arzneimittelinduzierte Störungen des Vitamin-D-Haushaltes erscheinen mit Sicht auf das hohe präventivmedizinische Potenzial des Sonnenvitamins im neuen Licht. Von zahlreichen Arzneimitteln ist bekannt, dass sie mit dem Vitamin-D-Stoffwechsel interferieren (s. Tabelle).
Arzneistoffe, die den Pregnan-X-Rezeptor (PXR) aktivieren können (Auswahl) | |
PXR-Liganden |
Beispiele |
Androgenrezeptor-Antagonisten |
Cyproteronacetat |
Antiepileptika |
Phenytoin, Carbamazepin |
Antiestrogene |
Tamoxifen |
Antihypertonika |
Nifedipin, Spironolacton |
Antimykotika |
Clotrimazol |
|
antiretrovirale Arzneimittel
(NNRTI/Proteasehemmer)
|
Efavirenz, Nevirapin/ Ritonavir, Saquinavir |
Antituberkulotika |
Rifampicin |
Glucocorticoide |
Dexamethason |
Phytopharmaka |
Kava kava, Johanniskraut (Hyperforin) |
Zytostatika |
Cyclophosphamid, Paclitaxel |
Ein Arzneimittel-induzierter Vitamin-D-Mangel (25-OH-D < 20 ng/ml) kann sich u. a. in einem sekundären Hyperparathyreoidismus, Störungen der Knochenmineralisierung bis hin zur Osteoporose äußern. Bekannte Beispiele hierfür sind die Antiepileptika-, Corticoid- oder Virustatika-induzierte Osteopathie. Arzneistoffe, wie das Antiepileptikum Phenytoin oder das Glucocorticoid Dexamethason können den Pregnan-X-Rezeptor stimulieren und hierüber die 24-Hydroxylase (24-OHase) aktivieren. Die 24-OHase baut 25-OH-Vitamin D und 1,25-(OH)2-Vitamin D in nicht mehr stoffwechselaktive Vitamin-D-Metaboliten ab. Vitamin D wird dadurch inaktiviert und verliert seine Stoffwechselfunktion. Arzneistoffe, die den Pregnan-X-Rezeptor stimulieren, können daher potenziell alle negativen Folgen auslösen, die mit einem Vitamin-D-Mangel einhergehen.
KommentarGrundsätzlich sollte bei jeder Langzeitmedikation der Vitamin-D-Status des behandelten Patienten kontrolliert werden, da bisher noch nicht alle Agonisten des Pregnan-X-Rezeptors unter den Arzneistoffen, die Vitamin D abbauen können, beschrieben worden sind. Ein optimaler 25-OH-Vitamin-D-Status liegt bei 40 bis 60 ng/ml bzw. 100 bis 150 nmol/l! |
Schlussbemerkung
Dem Vitamin-D-Mangel sollte in der ärztlichen und pharmazeutischen Praxis größere Aufmerksamkeit als bisher geschenkt werden. Die bisher vorliegenden Daten zu Vitamin D aus experimentellen, ökologischen, Fall-Kontroll-, Retro- und prospektiven Beobachtungsstudien sowie kleinen Interventionsstudien sind beachtlich und bescheinigen dem Vitamin D eine essenzielle Rolle bei vielen physiologischen und präventivmedizinischen Funktionen, inklusive neuropsychiatrischer Erkrankungen. Die Ergebnisse dieser Studien rechtfertigen in jedem Fall die Empfehlung, den Vitamin-D-Status bei Kindern und Erwachsenen allgemein durch einen gesunden Umgang mit der Sonnenlicht-Exposition, dem Verzehr Vitamin-D-haltiger Lebensmittel und der Supplementierung von Vitamin-D-Präparaten zu verbessern. Nichtsdestotrotz müssen wir in vielen Bereichen die Ergebnisse aus kontrollierten und randomisierten Interventionsstudien in den kommenden Jahren abwarten, bei denen Vitamin D in ausreichend hoher Dosierung eingesetzt wird [1, 2, 8, 48].
VERANSTALTUNGSTIPP
Vitamin-D-Kongress und 1. Berliner Mikronährstoff-SymposiumEine gemeinsame Veranstaltung vom Institut für medizinische Information und Prävention in Kooperation mit der Akademie für Mikronährstoffmedizin findet im Audimax der Charité/Berlin vom 19. April bis 20. April statt.
Weitere Informationen zum Kongress finden Sie unter www.mikronaehrstoff.de |
Literatur 1. Wacker M, Holick MF. Vitamin D-Effects on skeletal and extraskeletal health and the need for supplementation. Nutrients, 2013; 5(1): 111–148. 2. Gröber U, Holick MF. Vitamin D: Die Heilkraft des Sonnenvitamins. 2.Auflage, 304 S., Wissenschaftliche Verlagsgesellschaft, Stuttgart, 2013. 3. Holick, MF. Vitamin D deficiency. N Engl J Med, 2007; 357: 266–281. 4. Gröber U, Mücke R, Adamietz IA et al. Komplementärer Einsatz von Antioxidanzien und Mikronährstoffen in der Onkologie - Update 2013. Der Onkologe, 2013; 19(2): 136-143. 5. Grant WB, Tangpricha V, Vitamin D: Its role in disease prevention. Dermatoendocrinol, 2012; 4(2): 81-83. 6. Mohr SB, Gorham ED, Alcaraz JE, et al. Does the evidence for an inverse relationship between serum vitamin D status and breast cancer risk satisfy the Hill criteria? Dermatoendocrinol, 2012; 4(2): 152-157. 7. Reichrath J, Lehmann B, Spitz J. Vitamin D: Update 2012. 244 S., Dustri Verlag, München, 2012. 8. Spitz J, Vitamin D: Das Sonnenhormon für unsere Gesundheit und der Schlüssel zur Prävention. 248 S., Gesellschaft für medizinische Information und Prävention, Schlangenbad, 2009. 9. Zittermann A, Iodice S, Pilz S, et al. Vitamin D deficiency and mortality risk in the general population: a meta-analysis of prospective cohort studies. Am J Clin Nutr, 2012; 95(1): 91–100. 10. Schöttker B, Haug U, Schomburg L, et al. Strong associations of 25-hydroxyvitamin D concentrations with all-cause, cardiovascular, cancer, and respiratory disease mortality in a large cohort study. Am J Clin Nutr, 2013; 97(4): 782-793. 11. Valcour A, Blocki F, Hawkins DM et al. Effects of age and serum 25-OH-vitamin D on serum parathyroid hormone levels. J Clin Endocrinol Metab, 2012; 97(11): 3989–3995. 12. Holick MF, Binkley NC, Bischoff-Ferrari HA et al. Guidelines for preventing and treating vitamin D deficiency and insufficiency revisited. J Clin Endocrinol Metab, 2012; 97(4): 1153–1158. 13. Bischoff-Ferrari HA, Willett WC, Orav EJ, et al. A pooled analysis of vitamin D dose requirements for fracture prevention. N Engl J Med, 2012; 367(1): 40-49. 14. Bischoff-Ferrari HA, Borchers M, Gudat F et al. Vitamin D receptor expression in human muscle tissue decreases with age. J Bone Miner Res, 2004; 19 (2): 265–269 15. Ceglia L, da Silva Morais M, Park LK et al. Multi-step immunofluorescent analysis of vitamin D receptor loci and myosin heavy chain isoforms in human skeletal muscle. J Mol Histol. 2010; 41(2-3): 137–142 16. Bischoff-Ferrari HA, Dawson-Hughes B, Staehelin HB et al. Fall prevention with supplemental and active forms of vitamin D: a meta-analysis of randomised controlled trials. BMJ, 2009; 339 (1): 339: b3692. 17. Dobnig H, Pilz S, Scharnagl H et al. Independent association of low serum 25-hydroxyvitamin D and 1, 25-dihydroxyvitamin D levels with all-cause and cardiovascular mortality. Arch Intern Med, 2008; 168 (12): 1340–1349. 18. Anderson JL, May HT, Horne BD et al. Relation of vitamin D deficiency to cardiovascular risk factors, disease status, and incident events in a general healthcare population. Am J Cardiol, 2010; 106(7): 963–968. 19. Mullie P, Autier P. Relation of vitamin D deficiency to cardiovascular disease. Am J Cardiol, 2011; 107(6): 956 20. Witham MD, Nadir MA, Struthers AD. Effect of vitamin D on blood pressure: a systematic review and meta-analysis. J Hypertens, 2009; 27(10): 1948-1954. 21. Forman JP, Scott JB, Ng K et al. Effect of vitamin D supplementation on blood pressure in blacks. Hypertension, 2013; 61(4): 779-785. 22. Gröber U, Arzneimittel und Mikronährstoffe. 3., korrigierte Auflage, Wissenschaftliche Verlagsgesellschaft, Stuttgart, 2013.23. Shedeed SA, Vitamin D supplementation in infants with chronic congestive heart failure. Pediatr Cardiol, 2012; 33(5): 713-719. 24. Hyppönen E, Läärä E, Reunanen A et al. Intake of vitamin D and risk of type 1 diabetes: a birth cohort study. Lancet, 2001; 358(9292): 1500-1503. 25. Zipitis, CS, Akobeng, AK. Vitamin D supplementation in early childhood and risk of type 1 diabetes: a systematic review and meta-analysis. Arch Dis Child, 2008; 93(6): 512-517. 26. Sørensen IM, Joner G, Jenum PA, et al. Maternal serum levels of 25-hydroxy-vitamin D during pregnancy and risk of type 1 diabetes in the offspring. Diabetes, 2012; 61(1): 175-178. 27. von Hurst PR, Stonehouse W, Coad J. Vitamin D supplementation reduces insulin resistance in South Asian women living in New Zealand who are insulin resistant and vitamin D deficient - a randomised, placebo-controlled trial. Br J Nutr, 2010; 103(4): 549-555. 28. Gagnon C, Lu ZX, Magliano DJ, et al. Low serum 25-hydroxyvitamin D is associated with increased risk of the development of the metabolic syndrome at five years: results from a national, population-based prospective study (The Australian Diabetes, Obesity and Lifestyle Study: AusDiab). J Clin Endocrinol Metab, 2012; 97(6): 1953-1961. 29. Deleskog A, Hilding A, Brismar K, et al. Low serum 25-hydroxyvitamin D level predicts progression to type 2 diabetes in individuals with prediabetes but not with normal glucose tolerance. Diabetologia, 2012; 55(6): 1668–1678. 30. Bischoff-Ferrari HA, Shao A, Dawson-Hughes B et al. Benefit-risk assessment of vitamin D supplementation. Osteoporos Int, 2010; 21 (7): 1121–1132. 31. Ginde AA, Mansbach JM, Camargo CA Jr, Association between serum 25-hydroxyvitamin D level and upper respiratory tract infection in the Third National Health and Nutrition Examination Survey. Arch Intern Med, 2009; 169(4): 384–390. 32. Urashima M, Segawa T, Okazaki M et al. Randomized trial of vitamin D supplementation to prevent seasonal influenza A in schoolchildren. Am J Clin Nutr, 2010; 91(5):1255–1260. 33. Aloia JF, Li-Ng M, Re: epidemic influenza and vitamin D. Epidemiol Infect. 2007; 135(7): 1095-1096. 34. Amestejani M, Salehi BS, Vasigh M, et al. Vitamin D supplementation in the treatment of atopic dermatitis: a clinical trial study. J Drugs Dermatol, 2012; 11(3): 327-330. 35. Javanbakht MH, Keshavarz SA, Djalali M, et al. Randomized controlled trial using vitamins E and D supplementation in atopic dermatitis. J Dermatolog Treat, 2011; 22(3): 144-150. 36. Javanbakht M, Keshavarz S, Mirshafiey A, et al. The effects of vitamins E and D supplementation on erythrocyte superoxide dismutase and catalase in atopic dermatitis. Iran J Public Health, 2010; 39(1): 57-63. 37. Abbas S, Linseisen J, Slanger T, Kropp S, Mutschelknauss EJ, Flesch-Janys D, Chang-Claude JSerum 25-hydroxyvitamin D and risk of post-menopausal breast cancer--results of a large case-control study. Carcinogenesis, 2008; 29(1): 93-99. 37a. Churilla TM, Brereton HD, Klem M, Peters CA. Vitamin D deficiency is widespread in cancer patients and correlates with advanced stage disease: a community oncology experience. Nutr Cancer, 2012; 2012;64(4):521-515. 38. Gorham ED, Garland CF, Garland FC, Grant WB, Mohr SB, Lipkin M, Newmark HL, Giovannucci E, Wei M, Holick MF. Optimal vitamin D status for colorectal cancer prevention: a quantitative meta analysis. Am J Prev Med, 2007; 32(3): 210-216. 39. Drake MT, Maurer MJ, Link BK, Habermann TM, Ansell SM, Micallef IN, Kelly JL, Macon WR, Nowakowski GS, Inwards DJ, Johnston PB, Singh RJ, Allmer C, Slager SL, Weiner GJ, Witzig TE, Cerhan JR. Vitamin D insufficiency and prognosis in non-Hodgkin‘s lymphoma. J Clin Oncol, 2010; 28(27): 4191-4198. 40. Lappe JM, Travers-Gustafson D, Davies KM, Recker RR, Heaney RP. Vitamin D and calcium supplementation reduces cancer risk: results of a randomized trial. Am J Clin Nutr, 2007; 85(6): 1586-1591. 41. Goodwin PJ, Ennis M, Pritchard KI, et al. Prognostic effects of 25-hydroxyvitamin D levels in early breast cancer. J Clin Oncol, 2009; 27(23): 3757-3763. 42. Santini D, et al. Longitudinal evaluation of vitamin D plasma levels during anthracycline- and docetaxel-based adjuvant chemotherapy in early-stage breast cancer patients. Ann Oncol, 2010; 21(1): 185-186. 43. Fink, M, Vitamin D deficiency is a cofactor of chemotherapy-induced mucocutaneous toxicity and dysgeusia. J Clin Oncol, 2011; 29(4): e81-e8 44. Prieto-Alhambra, D, et al. Vitamin D threshold to prevent aromatase inhibitor-induced arthralgia: a prospectiv cohort study. Breast Cancer Res Tret, 2011; 125(3): 869-878. 45. Khan QJ, Reddy PS, Kimler BF, Sharma P, Baxa SE, O‘Dea AP, Klemp JR, Fabian CJ. Effect of vitamin D supplementation on serum 25-hydroxy vitamin D levels, joint pain, and fatigue in women starting adjuvant letrozole treatment for breast cancer. Breast Cancer Res Treat, 2010; 119(1):111-118. 46. Carmel AS, Shieh A, Bang H, Bockman RS. The 25(OH)D level needed to maintain a favorable bisphosphonate response is ≥ 33 ng/ml. Osteoporos Int, 2012; 23(10): 2479-2487. 47. Gröber, U, Kisters, K. Influence of drugs on vitamin D and calcium metabolism. Dermatoendocrinol, 2012; 4(2): 158-166. 48. Eyles DW, Burne TH, McGrath JJ. Vitamin D, effects on brain development, adult brain function and the links between low levels of vitamin D and neuropsychiatric disease. Front Neuroendocrinol, 2013; 34(1): 47-64. 49. Talaei A, Mohamadi M, Adgi Z. The effect of vitamin D on insulin resistance in patients with type 2 diabetes. Diabetol Metab Syndr, 2013; 5(1): 8. 50. Hossein-Nezhad A, Spira A, Holick MF. Influence of vitamin D status and vitamin D3 supplementation on genome wide expression of white blood cells: a randomized double-blind clinical trial. PLoS One, 2013; 8(3): e58725.
Apotheker Uwe Gröber
Akademie für Mikronährstoffmedizin, Essen
www.mikronaehrstoff.de
Prof. Dr. med. Jörg Spitz
Institut für medizinische Information und Prävention, Wiesbaden
Prof. Dr. med. Michael F. Holick
Dr. med. Matthias Wacker
Boston University Medical Center, Massachusetts
Prof. Dr. med. Klaus Kisters
Akademie für Mikronährstoffmedizin, Essen
St. Anna Hospital, Medizinische Klinik I, Herne






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.