
- DAZ.online
- DAZ / AZ
- DAZ 1/2013
- Weniger Injektionen dank ...
Arzneimittel und Therapie
Weniger Injektionen dank Status-orientierter Therapie
Die altersbedingte Makuladegeneration (AMD) gilt als die häufigste Erblindungsursache bei über 60-Jährigen. Schätzungsweise ist bereits jeder vierte der über 65-Jährigen von einer AMD betroffen. "Werden wir nur alt genug, bekommen wir alle eine AMD", so Prof. Dr. Michael Ulbig von der Augenklinik am Klinikum der Universität Marburg auf einer von der Bayer HealthCare unterstützten Pressekonferenz in Frankfurt. Neben dem Alter zählen Rauchen und eine entsprechende genetische Disposition zu den wesentlichen Risikofaktoren, auch oxidative Schäden durch Licht, die Ernährung sowie Erkrankungen wie Bluthochdruck, Diabetes oder Arteriosklerose werden mit einer AMD assoziiert.
Unterschieden werden zwei Verlaufsformen: die trockene und die feuchte AMD. Die häufigste Form ist die trockene AMD, bei der über Jahre schleichend lichtempfindliche Zellen der Netzhaut des Auges verloren gehen, aber meistens bleibt die Lesefähigkeit lange erhalten. Seltener, dabei wesentlich aggressiver, ist die feuchte Form der Makuladegeneration. Hier werden durch Alterungsprozesse in der zentralen Netzhaut Abfallprodukte (Drusen) unter die Makula abgelagert. Diese altersbedingte Makulopathie führt zu keiner relevanten Einschränkung des Sehvermögens, gilt aber als Vorstufe der altersbedingten Makuladegeneration. Die Drusen lösen entzündungsähnliche Reaktionen aus. Es kommt zu einer vermehrten Ausschüttung von Wachstumsfaktoren. Im Bereich der Makula führt dies zu einer chorioidalen Neovaskularisation (CNV). Irreguläre Blutgefäße aus der Aderhaut sprossen unter das retinale Pigmentepithel und die Netzhaut ein. Aus diesen krankhaften und durchlässigen Blutgefäßen tritt im Bereich der Stelle des schärfsten Sehens Flüssigkeit aus. Es kann zu Netzhautverdickung, Netzhautödem oder intraretinalen Blutungen kommen. Als Folge sehen die Betroffenen "verzerrt", es kommt zu einer irreversiblen Visusminderung bis zur Erblindung.
VEGF-Inhibitoren stoppen Neovaskularisation
Viele Jahre lang war die Laserbehandlung auf Basis der Fluoreszenzangiographie die einzig erfolgreiche Methode, bei feuchter AMD den Sehschärfeverlust für wenige Jahre zu verhindern. Die photodynamische Therapie mit Verteporfin und Laser konnte auch nur die weitere Verschlechterung der Sehschärfe verlangsamen. Wachstumsfaktoren wie der vaskuläre endotheliale Wachstumsfaktor A (VEGF-A) und der Plazenta-Wachstumsfaktor (PlGF) sind angiogene Faktoren, die bei der Regulation von Gefäßneubildungen und -durchlässigkeit eine wichtige Rolle spielen. VEGF bindet an die beiden Rezeptor-Tyrosinkinasen VEGFR-1 und VEGFR-2, die sich an der Oberfläche von Endothelzellen befinden. Der Plazenta-Wachstumsfaktor PlGF bindet nur an die Rezeptor-Tyrosinkinase VEGFR-1, die sich auch auf der Oberfläche von Leukozyten befindet. Aktiviert VEGF-A diese Rezeptoren, so kommt es zur pathologischen Neovaskularisation und erhöhter vaskulärer Permeabilität – ein wichtiger Schritt in der Pathogenese der AMD. Um die pathologische choroidale Neovaskularisation im Auge zu stoppen, wurden VEGF-Hemmer entwickelt, die lokal intravitreal appliziert werden. Der erste für die Indikation zugelassene VEGF-Hemmstoff war das Oligonukleotid Pegaptanib (Macugen®), das spezifisch an den VEGF-A-Subtyp 165 bindet und ihn dadurch blockiert. Der monoklonale VEGF-Antikörper Ranibizumab (Lucentis®) inhibiert im Gegensatz zu Pegaptanib alle VEGF-A-Isoformen. Vor allem der hohe Preis von Ranibizumab führte dazu, dass der bei Darmkrebs zugelassene VEGF-Hemmstoff Bevacizumab (Avastin®) off-label bei der AMD eingesetzt wird. Ranibizumab ist ein Fragment von Bevacizumab, beide haben denselben Wirkmechanismus, Ranibizumab ist aber kleiner und soll die Netzhaut besser durchdringen. Das neue Aflibercept (Eylea®) ist ein rekombinantes Fusionsprotein, das als löslicher Köderrezeptor agiert und VEGF-A und PlGF mit höherer Affinität als deren natürliche Rezeptoren bindet.
Soziale Folgen der AMDUnterschätzt werden darf nicht, dass visuelle Einschränkungen einen großen Einfluss auf den Alltag haben. So kann ein reduziertes Kontrastsehen zu einer zunehmenden Gangunsicherheit beitragen und das Sturzrisiko erhöhen. Auch die Fahrtauglichkeit und die Mobilität sind in Gefahr. Die Erkrankung hat durch den Kontrollverlust und die fortschreitenden Beschwerden große psychologische Auswirkungen. Nicht selten entsteht eine konkrete Erblindungsangst, entwickeln sich Depression und Demenz. Untersuchungen haben gezeigt, dass sogar eine geringe Visusminderung das Sterblichkeitsrisiko um mehr als das Doppelte erhöhen kann, betonte Prof. Dr. Focke Ziemssen von der Universitätsaugenklinik Tübingen. Die aufwändige Therapie, die viel Zeit für Diagnostik und Behandlung mit häufigen regelmäßigen Arztterminen beansprucht, belastet Patienten und ihre Angehörigen erheblich. |
Weniger intravitreale Applikationen notwendig
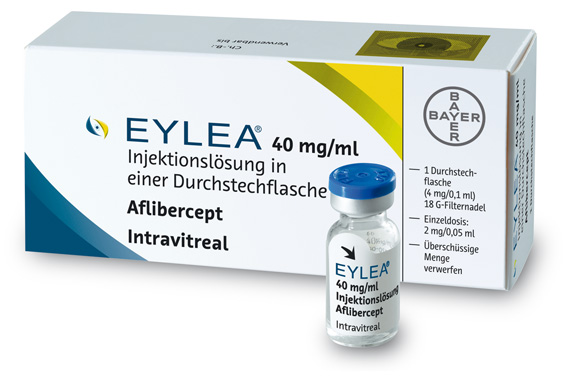
Eylea® ist kühlkettenpflichtig und muss im Kühlschrank gelagert werden. Vor der Anwendung kann die ungeöffnete Durchstechflasche bis zu 24 Stunden bei Raumtemperatur (unter 25 °C) aufbewahrt werden. Aflibercept darf nur von einem qualifizierten Arzt mit Erfahrung in der Durchführung intravitrealer Injektionen appliziert werden. Die empfohlene Dosis beträgt 2 mg Aflibercept in einer Einzeldosis von 50 µl. Zur Verfügung stehen Vials, die 100 µl der Lösung enthalten. Aus ihnen wird unter sterilen Bedingungen die entsprechende Menge mittels einer Filternadel entnommen, der Rest darf nicht mehr verwendet werden. Bayer arbeitet an der Bereitstellung einer Fertigspritze, damit entsprechend weniger Substanz verworfen werden muss. In den von Bayer HealthCare unterstützten zulassungsrelevanten Studien (VEGF Trap-Eye: Investigation of Efficacy and Safety in Wet AMD, View 1 und View 2) wurde die Wirkung von Aflibercept an insgesamt über 2400 Patienten mit einem mittleren Alter von 76 Jahren untersucht. Eingesetzt wurden vier Therapieregime nach einer initialen Phase von drei Injektionen monatlich:
Ranibizumab 0,5 mg alle 4 Wochen (n = 595)
Aflibercept 2,0 mg alle 4 Wochen (n= 613)
Aflibercept 0,5 mg alle 4 Wochen sowie (n =597)
Aflibercept 2,0 mg alle 8 Wochen (n = 607)
Die Studiendauer betrug 52 Wochen. Ziel dieser randomisierten, doppelblinden Phase-III-Studien war es zu zeigen, dass eine Behandlung mit Aflibercept nach initial dreimal monatlicher Verabreichung nachfolgend auch in einem zweimonatlichen Rhythmus eine andauernde Verbesserung der Sehkraft erzielen kann und der Behandlung mit Ranibizumab im monatlichen Rhythmus nicht unterlegen ist. Primärer Endpunkt war der Anteil der Patienten, die nach 52 Wochen Behandlung ihre Sehkraft erhalten oder verbessert hatten. Dabei wurde "Erhalt der Sehkraft" als ein Verlust von weniger als 15 Buchstaben gemessen an korrekt erkannten Buchstaben definiert. Alle Therapieregime mit Aflibercept erwiesen sich in Bezug auf den primären Endpunkt Visuserhalt als nicht unterlegen. Bei über 90% der Patienten in allen Studienarmen konnte die Sehkraft erhalten werden, etwa 30% der Patienten in allen Studienarmen hatten ihre Sehkraft sogar um ≥ 15 Buchstaben verbessert. Von Ranibizumab waren zum Erreichen dieser Ziele bis Woche 96 16,5 Injektionen erforderlich, von Aflibercept 2 mg alle 4 Wochen 16,0 Injektionen; Aflibercept 0,5 mg alle 4 Wochen 16,2 und Aflibercept 2 mg alle 8 Wochen nur 11,2 Injektionen notwendig. Nach einer initialen Behandlung mit drei Injektionen in jeweils monatlichen Abständen wird damit eine individualisierte Therapie möglich. Nachdem der Augenarzt die funktionelle und morphologische Situation einschätzt, kann die Behandlung nach einem anpassbaren Schema durchgeführt werden, so dass die Injektionsintervalle verlängert werden können und weniger Injektionen notwendig werden. Aflibercept und Ranibizumab zeigten in den Studien ein insgesamt vergleichbares Sicherheitsprofil. Zu den schwerwiegende Nebenwirkungen, die mit dem Injektionsverfahren in Zusammenhang standen, zählen Endophthalmitis, traumatischer Katarakt und ein vorübergehender Anstieg des Augeninnendrucks. Die häufigsten Nebenwirkungen (bei mindestens 5% der mit Aflibercept behandelten Patienten) waren Bindehautblutung, Augenschmerzen, Glaskörperabhebung, Katarakt und erhöhter Augeninnendruck. Nach intravitrealer Anwendung unterliegt Aflibercept einer langsamen systemischen Resorption aus dem Auge. Im systemischen Kreislauf liegt es überwiegend als inaktiver, stabiler Komplex mit VEGF vor und wird durch proteolytischen Abbau eliminiert.
Weitere Einsatzmöglichkeiten für Aflibercept
Bayer hat mit der amerikanischen Firma Regeneron einen Lizenzvertrag über die gemeinsame Entwicklung und Vermarktung von Aflibercept abgeschlossen, das bei verschiedenen Netzhauterkrankungen klinisch geprüft wird, wie Prof. Dr. Frank G. Holz vom Universitätsklinikum Bonn ausführte. Ergänzend zu der Indikation neovaskuläre AMD laufen derzeit Phase-III-Studien zur Behandlung des diabetischen Makulaödems und der durch starke Kurzsichtigkeit bedingten choroidalen Neovaskularisation. Auch für die Indikation Zentralvenenverschluss der Netzhaut (ZVV) wird in Europa die Zulassung beantragt. In den USA ist Aflibercept bereits zur Behandlung der neovaskulären AMD und des Makulaödems nach ZVV zugelassen. Regeneron entwickelt den gleichen Wirkstoff – allerdings in einer anderen Formulierung – in Kooperation mit Sanofi-Aventis auch für die Anwendung in der Onkologie. Der Hersteller rechnet in Kürze mit der europäischen Zulassung beim Kolonkarzinom. Die Food and Drug Administration hat Aflibercept (Zaltrap®) in Kombination mit Fluorouracil, Leucovorin und Irinotecan in den USA bereits für die Behandlung von Patienten mit metastasiertem Kolorektalkarzinom zugelassen.
Steckbrief: AfliberceptHandelsname: Eylea Hersteller: Bayer Vital GmbH Einführungsdatum: 15. Dezember 2012 Zusammensetzung: 1 Durchstechflasche enthält 40 mg Aflibercept/ml Injektionslösung. Packungsgrößen, Preise und PZN: 1 Durchstechflasche (N1), 1260,90 Euro, PZN 09299319. Stoffklasse: Ophthalmika/antineovaskuläre Mittel, ATC-Code: S01LA05. Indikation: bei Erwachsenen zur Behandlung der neovaskulären (feuchten) altersabhängigen Makuladegeneration (AMD). Dosierung: Die empfohlene Dosis beträgt 2 mg Aflibercept, entsprechend 50 µl Injektionslösung. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff Aflibercept oder einen der sonstigen Bestandteile; bestehende oder vermutete okulare oder periokulare Infektion; bestehende schwere intraokulare Entzündung. Nebenwirkungen: sehr häufig: Bindehautblutung, Augenschmerzen; häufig: Netzhautablösung, Einriss oder Abhebung des retinalen Pigmentepithels, Netzhautdegeneration, Katarakt, Kernkatarakt, Hornhautabrasion, Anstieg des Augeninnendrucks, Verschwommenes Sehen, Glaskörperschlieren, Hornhautödem, Glaskörperabhebung, Schmerzen an der Injektionsstelle, Fremdkörpergefühl im Auge, Erhöhte Tränensekretion, Augenlidödem, Blutungen an der Injektionsstelle, Bindehauthyperämie, okuläre Hyperämie. Gelegentlich: Überempfindlichkeit; Endophthalmitis, Einriss der Retina, Glaskörperblutung, Rindenkatarakt, Linsentrübungen, Hornhautepitheldefekt, Hornhauterosion, Vitritis, Uveitis, Iritis, Iridocyclitis, Schwebeteilchen in der Vorderkammer. Wechselwirkungen: Es wurden keine Studien zur Erfassung von Wechselwirkungen durchgeführt. Eine kombinierte Anwendung einer photodynamischen Therapie (PDT) mit Verteporfin und Aflibercept wurde nicht untersucht, daher liegt hierzu kein Sicherheitsprofil vor. Warnhinweise und Vorsichtsmaßnahmen: Intravitreale Injektionen können zu einer Endophthalmitis führen. Bei der Applikation sind immer angemessene aseptische Injektionsmethoden anzuwenden. Patienten sollten unverzüglich alle Symptome melden, die auf eine Endophthalmitis hinweisen, und diese müssen angemessen behandelt werden. Anstiege des Augeninnendrucks wurden innerhalb von 60 Minuten nach intravitrealen Injektionen beobachtet. Besondere Vorsicht ist bei Patienten mit einem schlecht eingestellten Glaukom geboten! Aflibercept darf nicht injiziert werden, solange der Augeninnendruck bei ≥ 30 mmHg liegt. Da Aflibercept ein therapeutisches Protein ist, besteht die Möglichkeit einer Immunogenität. Patienten sollten auf alle Anzeichen einer intraokularen Entzündung, z. B. Schmerzen, Photophobie oder Rötung achten, da diese klinische Anzeichen einer Überempfindlichkeit sein könnten. |
Quelle Heier, J.S. et al.: Intravitreal Aflibercept (VEGF Trap-Eye) in Wet Age-related Macular Degeneration. Ophthalmology (2012) 119: 2537 – 2548. Fachinformation Eylea, Stand November 2012. Die Anti-VEGF-Therapie bei der neovaskulären AMD: Therapeutische Strategien. Stellungnahme von DOG, Retinologischer Gesellschaft und BVA Deutschlands. Stand Februar 2012.
ck
DAZ 2013, Nr. 1/2, S. 36























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.