
- DAZ.online
- DAZ / AZ
- DAZ 39/2011
- Die tiefe Venenthrombose
Medizin
Die tiefe Venenthrombose
Bei der akuten tiefen Venenthrombose (TVT) handelt es sich um eine komplette oder inkomplette Verlegung der Leit- und/oder Muskelvenen durch einen Thrombus. Am häufigsten tritt eine TVT in unterschiedlichen Abschnitten der unteren Extremität auf, entweder als distale Unterschenkelthrombose (20%), als proximale Oberschenkelthrombose (V. femoralis 50%, V. poplitea 20%) oder als stammnahe Beckenvenenthrombose (V. iliaca 20%). Da links die A. iliaca die V. iliaca überkreuzt und dies eine gewisse Abflussbehinderung darstellt, ist das linke Bein doppelt so häufig betroffen wie das rechte. Die jährliche Inzidenz einer Phlebothrombose in Deutschland beträgt etwa 1: 1000.
Gefürchtete Komplikationen
Gefährlich ist die tiefe Venenthrombose aufgrund ihrer möglichen schwerwiegenden Komplikationen:
In der Akutphase droht eine Lungenembolie (Inzidenz 60 bis 70 pro 100.000 Einwohner und Jahr, Embolisation eines Thrombus in 90% der Fälle aus den tiefen Bein- und Beckenvenen),
Eher selten ist eine perakute Aufthrombosierung mehrerer Venen bis zur Phlegmasia coerulea dolens (s. Kasten).
Nach Jahren kann sich ein postthrombotisches Syndrom mit nachfolgendem Ulcus cruris entwickeln (nach distaler TVT in etwa einem Drittel, nach proximaler in rund der Hälfte der Fälle) (s. Kasten).
Phlegmasia coerulea dolensSelten kommt es zum perakuten Verlauf einer ausgedehnten Mehretagenthrombose mit rasch progredienter, massiver, zyanotischer und hoch schmerzhafter Schwellung. Konsekutiv droht eine arterielle Minderdurchblutung akraler Bezirke bis zu Zehen- oder Vorfußnekrosen, die im Extremfall eine Amputation erforderlich machen. |
Postthrombotisches SyndromIm Zuge der entzündlichen und bindegewebigen Organisation des Thrombus werden häufig die Venenklappen zerstört. Durch den gestörten venösen Rückfluss kommt es zur chronisch venösen Insuffizienz. Zunächst bilden sich Ödeme und sekundäre Varizen, später entwickelt sich durch Hämosiderineinlagerung eine Braunfärbung der Haut sowie als Folge weiterer sklerotischer Gewebsveränderungen ein chronisches Unterschenkelgeschwür (Ulcus cruris). |
Die Virchow-Trias
Pathogenetisch kann auch noch heute die sog. Virchow-Trias als Modell für die Entstehung einer Thrombose dienen. Auch wenn die genannten Vorgänge jeder für sich betrachtet als prädisponierend betrachtet werden, rufen sie dennoch erst ab einem gewissen Summationseffekt bzw. im Verband mit weiteren Risikofaktoren eine Thrombose hervor:
Stase bzw. Verlangsamung der Blutströmung zumeist durch Immobilisierung (Bettlägerigkeit, Gipsverband, Sitzhaltung bei langen Flügen und Autofahrten), aber auch durch eine komprimierende Raumforderung,
Gefäßwandveränderungen (Endothelschäden) bei Entzündungsreaktion oder Tumorinfiltration, durch lokale Traumatisierung (auch operationsbedingt) oder Zytostatikawirkung,
Hyperkoagulabilität durch myeloproliferative Bluterkrankungen oder thrombophile Gerinnungsstörungen.
Zusätzliche Risikofaktoren für die Entstehung einer Venenthrombose sind weibliches Geschlecht, Östrogenwirkung, Schwangerschaft und Wochenbett, Adipositas, Varikosis, Rauchen und Exsikkose (z. B. nach forcierter Diurese).
Variable Symptomatik …
Die Zuverlässigkeit der klinischen Diagnostik hängt in der Regel davon ab, ob es sich um einen ambulanten/mobilen oder immobilen/bettlägerigen Patienten handelt. Bei letzteren verläuft die tiefe Beinvenenthrombose oft asymptomatisch, die diagnostische Treffsicherheit sinkt unter 30 Prozent. Bei bis kurz vor dem Ereignis mobilen Patienten können sich – mehr oder weniger ausgeprägt – an der betroffenen Extremität folgende Krankheitszeichen zeigen:
Schwellung mit Umfangsdifferenz,
Konsistenzunterschied (Verhärtung mit Spannungs- und Schweregefühl vor allem in der Wade),
dumpfe, ziehende Schmerzen mit Linderung bei Hochlagerung,
livide Verfärbung mit Zyanose insbesondere im Stehen,
lokale Überwärmung.
… und die Frage der Wahrscheinlichkeit
Die klassischen Druck- und Dehnungsschmerzzeichen (z. B. Payr: Fußsohlendruckschmerz) haben bei ambulanten Patienten eine Sensitivität zwischen 30 und 90 Prozent, die Spezifität jedoch ist gering. Bei ungezielter Anwendung von Anamnese und klinischer Untersuchung beträgt die Wahrscheinlichkeit, eine vorhandene Thrombose zu übersehen, 10 bis 20% – die Wahrscheinlichkeit, eine nicht vorhandene Thrombose fälschlicherweise zu diagnostizieren, jedoch 70%.
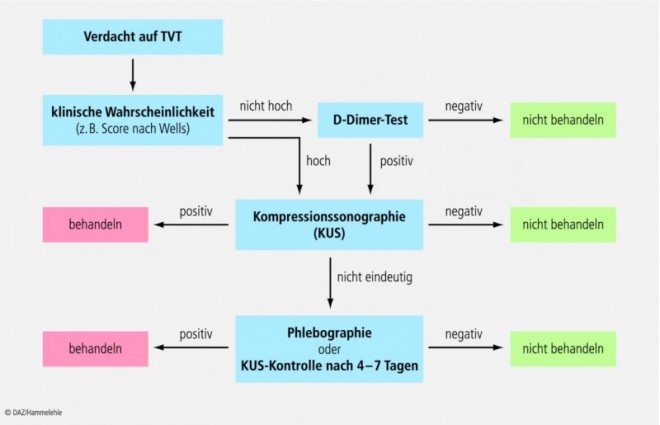
Daher wird der Evaluierung der klinischen Wahrscheinlichkeit einer tiefen Venenthrombose heute ein hoher Stellenwert eingeräumt. Hierzu werden standardisierten Informationen aus Anamnese und Untersuchung Punktwerte in Scores zugewiesen, deren Summe den Grad der Wahrscheinlichkeit definiert. Im klinischen Alltag hat sich der Wells-Score mit zweistufiger Graduierung bewährt (s. Tab.).
Tab.: Klinische Wahrscheinlichkeit einer tiefen Venenthrombose nach Wells (2003) | |
Klinische Charakteristik |
Score |
|
1,0 |
|
1,0 |
|
1,0 |
|
1,0 |
|
1,0 |
|
1,0 |
|
1,0 |
|
1,0 |
|
1,0 |
|
– 2,0 |
Klinische Wahrscheinlichkeit für TVT | |
|
≥ 2,0 |
|
≤ 2,0 |
Labordiagnostik: D-Dimere
D-Dimere entstehen als Endprodukte bei der Proteolyse des durch Faktor XIII quervernetzten Fibringerinnsels. Da jede Aktivierung der Gerinnungskaskade zur Erhaltung der physiologischen Balance eine Aktivierung der Fibrinolyse zur Folge hat, können D-Dimere als Marker für eine vermehrte Gerinnungsaktivität dienen. Allerdings ist ihr Nachweis nicht spezifisch für venöse Thromboembolien. Auch bei Schwangerschaft, Tumoren, Traumata, Entzündungsreaktionen sowie postoperativ werden erhöhte D-Dimer-Spiegel gemessen, womit eine geringe Spezifität zwischen 35 und 71% einhergeht. Aufgrund des hohen negativen prädiktiven Wertes eignet sich die Bestimmung der D-Dimere eher zur Ausschlussdiagnose einer tiefen Venenthrombose – jedoch nur nach vorheriger Score-Erfassung der klinischen Wahrscheinlichkeit.
Bildgebende Diagnostik
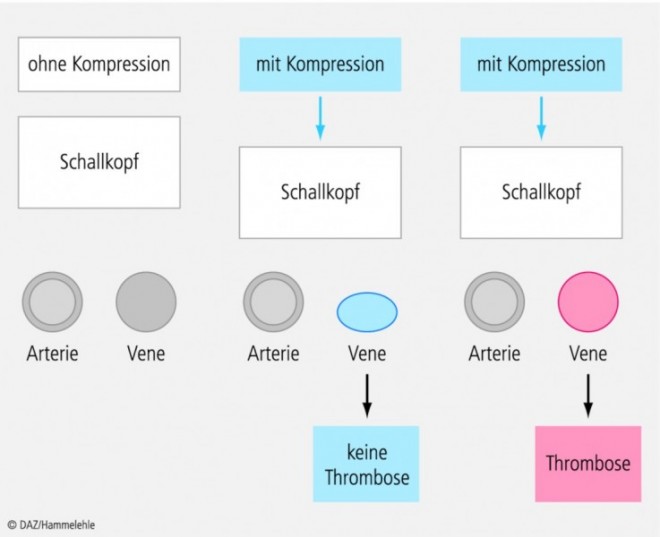
Methode der Wahl zum Nachweis und Ausschluss einer symptomatischen Beinvenenthrombose ist heute die – nicht invasive – Kompressionssonographie. Die fehlende Komprimierbarkeit der Vene im Querschnitt durch den Andruck der Ultraschallsonde gilt als wichtigstes Zeichen einer Thrombose (s. Abb. 1).
Bei einer proximalen Thrombose (Leisten-, Oberschenkel- und Kniebereich) ist die Aussagekraft generell am höchsten, die Zuverlässigkeit der Methode am Unterschenkel hingegen ist in der Regel von der Erfahrung des Untersuchers und der Qualität des Ultraschallgerätes abhängig. Für die Untersuchung der Beckenvenen eignet sich die Kompressionssonographie naturgemäß nicht, hier wird stattdessen die farbcodierte Duplexsonographie eingesetzt. Differenzialdiagnostisch können eine Baker-Zyste, ein Muskelfaserriss oder ein Tumor erkannt werden, Einschränkungen der Aussagekraft ergeben sich beispielsweise durch ausgeprägte Ödeme, Hämatome oder Narben, ebenso bei Adipositas.
Der Stellenwert der – invasiven – Phlebographie liegt heute in der Anwendung bei speziellen Indikationen, etwa bei unklaren Befunden, vor einer invasiven Therapie (Thrombektomie) und bei Verdacht auf eine Rezidivthrombose. Ihr Vorteil liegt in der Darstellung auch kleinster Gerinnsel (auch in Unterschenkelvenen) und Kollateralkreisläufen. Ein negativer Befund bei entsprechender Untersuchungsqualität schließt eine Thrombose mit hoher Sicherheit aus.
Die Magnetresonanz (MR)- und Computertomographie (CT)-Phlebographie weisen eine hohe Treffsicherheit in der Diagnostik einer ilio-femoro-poplitealen Venenthrombose auf, auch die Beckenstrombahn und die V. cava inferior können zweifelsfrei dargestellt werden.
Allerdings verhindert der hohe apparative Aufwand bzw. die relativ hohe Strahlenbelastung, diese beiden Verfahren in den derzeitigen diagnostischen Algorithmus zur Abklärung einer TVT für den Klinikalltag aufzunehmen (s. Abb. 2).
Umfelddiagnostik
Störungen der Blutgerinnung und Fibrinolyse (Thrombophilie), angeborene und erworbene Varianten oder Anomalien der Venen, sowie Tumore können für das Entstehen von Thrombosen verantwortlich sein. Für die Diagnostik und initiale Therapie einer akuten Thrombose ist die Abklärung dieser Ursachen in der Regel nicht von Bedeutung, wohl aber für die Sekundärprophylaxe oder eine anschließende Tumorsuche bei idiopathischer Venenthrombose.
Für hereditäre und erworbene Thrombophilien gilt, dass sie die Erstmanifestation einer venösen Thromboembolie begünstigen, sodass in Einzelfällen das relative Risiko bis auf das 80-Fache gegenüber der Normalbevölkerung erhöht sein kann. Für ein Rezidivereignis trifft dies jedoch nicht zu, insbesondere die häufigen genetischen Varianten, der heterozygote Faktor-V-Leiden-Defekt oder die heterozygote Prothrombin-20210-Mutation, sind nicht oder nur mit einer gering erhöhten Rezidivrate verknüpft. Beim erworbenen Antiphospholipid-Antikörper-Syndrom allerdings verdoppelt sich die Wahrscheinlichkeit für ein Rezidiv.
Ein breites Thrombophiliescreening bei akuter TVT wird in den aktuellen DAG-Leitlinien nicht empfohlen. Ausnahmen sind der begründete Verdacht auf ein Antiphospholipid-Antikörper-Syndrom, eine eindeutige Häufung unter erstgradigen Verwandten sowie die Einschätzung des Thromboserisikos bei Kontrazeption und Schwangerschaft.
Bei jüngeren, vor allem weiblichen Patienten, kann eine ilio-femorale Thrombose auch durch eine Venenanomalie oder -missbildung bedingt sein (z. B. May-Thurner-Syndrom, Aplasie der V. cava inferior). Auch diese Thrombosen sind typischerweise linksseitig lokalisiert.
Bei älteren Menschen führt nicht selten eine maligne Tumorerkrankung paraneoplastisch und/oder durch lokale Kompression zur Entstehung einer Thrombose. So ist zum einen bei etwa 15 Prozent der Patienten mit akuter TVT zum Diagnosezeitpunkt ein Malignom bekannt, zum anderen beträgt vor allem bei einem idiopathischen Ereignis das Risiko eines bisher nicht erkannten Malignoms ebenfalls bis zu 15 Prozent.
Initiale Antikoagulation
Therapeutisches Ziel bei akuter TVT ist es, Komplikationen wie die Lungenembolie oder das postthrombotische Syndrom zu verhindern. Bei gesicherter Thrombose ist eine sofortige Antikoagulation indiziert. Auch bei hoher klinischer Wahrscheinlichkeit sollte mit der Behandlung begonnen werden, bevor die Ergebnisse der diagnostischen Tests vorliegen. Gegenwärtig zugelassen sind unfraktionierte Heparine (UFH), niedermolekulare Heparine (NMH) und Fondaparinux. Heparine wirken als Kofaktor von Antithrombin, das aktivierte Gerinnungsfaktoren wie Thrombin und Faktor Xa hemmt.
UFH benötigen eine Bolusinjektion (5000 I.E. i.v.) und werden dann gewichtsadaptiert intravenös oder subkutan weiter appliziert, entweder 400 I.E. pro Kilo und Stunde als Dauerinfusion oder verteilt auf 2 bis 3 Einzeldosen pro Tag. Von Vorteil sind die gute Steuerbarkeit und die Möglichkeit der raschen Antagonisierung durch Protamin. Auch bei schwerer Niereninsuffizienz (Kreatinin-Clearance ≤ 30 ml/min) und im Rahmen gefäßrekanalisierender Maßnahmen sollten UFH eingesetzt werden. Nachteilig sind die obligate tägliche aPPT-Kontrolle (Ziel: Erhöhung auf das 1,5- bis 2,5-Fache) sowie die Gefahr der heparininduzierten Thrombozytopenie (HIT) Typ 2 (s. Kasten).
NMH, z. B. Dalteparin oder Enoxaparin, zeigen eine stärkere Wirkung auf den Faktor Xa als UFH und damit eine längere Halbwertszeit. Sie sind sicherer und mindestens genauso effektiv wie UFH, darüber hinaus einfacher in ihrer Anwendung: gewichtsadaptiert eine ein- bis zweimalige subkutane Gabe täglich ohne initiale Bolusinjektion, wobei eine routinemäßige Laborkontrolle (Anti-Xa-Aktivität) nicht notwendig ist. Bei einmal täglicher NMH-Gabe sollte sich 3 bis 4 Stunden nach Injektion im Anti-Xa-Test ein Wert zwischen 1,0 und 2,0 E/ml ergeben, bei zweimaliger Applikation zwischen 0,6 und 1,0 E/ml. Nicht zuletzt weil NMH wesentlich seltener zur HIT Typ 2 führen als UFH, stellen sie derzeit die Antikoagulanzien der ersten Wahl dar.
Das synthetisch hergestellte Fondaparinux bewirkt eine sehr spezifische Hemmung von Faktor Xa und wird einmal täglich in einer fixen Dosis von 7,5 mg subkutan injiziert (bei einem Körpergewicht unter 50 kg bzw. über 100 kg wird eine Dosisanpassung auf 5 bzw. 10 mg empfohlen). Der Anti-Xa-Test ist auch hier nur in Ausnahmefällen erforderlich, eine HIT Typ 2 ist unter Fondaparinux nicht zu erwarten.
HIT Typ 2 – kein Hit, aber paradox:Thrombosen unter AntikoagulationBei der immunologisch heparininduzierten Thrombozytopenie Typ 2 handelt es sich um eine durch ein Antikoagulans hervorgerufene prothrombotische Erkrankung. Nach der Bindung von Heparin an den Plättchenfaktor 4 kommt es zur Bildung von Antikörpern, die über eine Thrombozytenaktivierung einerseits zu einer Thrombozytopenie, andererseits zu einer vermehrten Thrombinbildung führen. Betroffene Patienten haben daher ein hohes Risiko für venöse und arterielle Thrombosen. Leitsymptome der HIT sind dementsprechend ein Abfall der Thrombozytenwerte > 50 Prozent und/oder neue thromboembolische Komplikationen (meist zwischen dem 5. und 14. Tag der Heparingabe). Therapeutisch ist – nach sofortigem Absetzen von Heparin – eine alternative Antikoagulation indiziert. Zur Verfügung stehen das Heparinoid Danaparoid-Natrium oder das Hirudin Lepirudin. |
Sekundärprophylaxe
Sofern keine Kontraindikationen bestehen oder invasive therapeutische Verfahren vorgesehen sind, wird bei jeder tiefen Venenthrombose – parallel zur initialen Antikoagulation mit Heparin oder Fondaparinux – umgehend die orale Sekundärprophylaxe mit einem Vitamin-K-Antagonisten eingeleitet. Wegen dessen verzögerten Wirkungseintritts muss die initiale Antikoagulation fortgesetzt werden, bis der Zielbereich der International Normalized Ratio (INR) zwischen 2,0 und 3,0 über mindestens 24 Stunden erreicht ist. In Deutschland wird zur Sekundärprophylaxe in der Regel Phenprocoumon (Marcumar®) eingesetzt, in angloamerikanischen Ländern zumeist Warfarin. Durch Vitamin-K-Antagonisten wird die Bildung der aktiven Gerinnungsfaktoren II, VII, IX und X aus inaktiven Vorstufen in der Leber gehemmt.
Generell gesichert ist die therapeutische Effizienz der Sekundärprophylaxe, weniger einheitlich sind die Empfehlungen zur Dauer – derzeit laut der achten ACCP Conference on Antithrombotic & Thrombolytic Therapy von 2008, z. B.
drei Monate bei Erstereignis und transienten Risikofaktoren (z. B. einer OP),
drei Monate bei distalem Erstereignis und idiopathischer Genese,
mehr als drei Monate bei proximalem Erstereignis und idiopathischer Genese bzw. dann zeitlich unbegrenzt wenn geringes Blutungsrisiko,
zeitlich unbegrenzt bei Rezidiv und idiopathischer Genese bzw. persistierenden Risikofaktoren,
wobei eine laborchemisch nachgewiesene Thrombophilie häufig keinen Einfluss auf die Dauer der Antikoagulation hat.
Hierbei sollte nicht nur in der initialen Phase, sondern auch im Verlauf das individuelle Nutzen-Risiko-Verhältnis mit Abschätzung des Blutungsrisikos berücksichtigt werden, insbesondere bei der Indikation zu einer verlängerten Sekundärprophylaxe. Große Blutungen treten bei Behandlung mit Vitamin-K-Antagonisten (INR 2,0 – 3,0) in etwa 1 bis 3 pro 100 Patientenjahre auf, weniger große (aber klinisch immer noch relevante) Blutungen sind etwa fünfmal häufiger. Durch Patientenschulung und Anleitung zur ärztlich kontrollierten Antikoagulanzien-Selbstkontrolle lassen sich Blutungskomplikationen deutlich reduzieren.
Phlebothrombose – unbedingt liegen lassen?Die strenge Immobilisierung von Patienten mit akuter tiefer Venenthrombose galt früher nahezu als Dogma. Inzwischen ist erwiesen, dass eine aktive Bewegungstherapie unter Kompression und Antikoagulation sogar von Vorteil ist: frühere Schmerzlinderung, raschere Abnahme der Beinschwellung, keine erhöhte Embolierate. Auch zeigte sich unter fünftägiger Bettruhe und korrekter Antikoagulation bei 26% der Thrombosepatienten eine phlebologisch dokumentierte Thromboseprogredienz gegenüber nur 1% unter 1- bis 2-tägiger Immobilisierung. Die erhaltene Mobilität des Patienten ist somit eine Grundvoraussetzung für die Thrombosebehandlung, zumal unter ambulanten Bedingungen. |
Ergänzende Maßnahmen
Eine Kompressionstherapie kann zur Linderung der Akutsymptome (Schwellung, Schmerz) effektiv beitragen, das Tragen eines Kompressionsstrumpfes mit einem Anlagedruck von 30 bis 40 mmHg (= Kompressionsklasse II) reduziert die Inzidenz des postthrombotischen Syndroms um ca. 50 Prozent. Die Dauer der Kompressionsbehandlung richtet sich auch nach dem Ergebnis von phlebologischen Kontrolluntersuchungen, die optimalerweise nach 3 bis 6 Monaten und dann in 6- bis 12-monatigen Intervallen erfolgen sollten. Bei Fortbestehen eines venösen Funktionsdefizits sollte die Kompression weitergeführt werden. Invasive thrombusbeseitigende Eingriffe haben das Ziel, eine postthrombotische Schädigung des Venensystems zu verhindern. Zur Verfügung stehen folgende Verfahren:
Thrombolyse: bei (jüngeren) Patienten mit einer < 14 Tage alten ilio-femoralen Thrombose und geringem Blutungsrisiko, heute eher kathetergesteuert als systemisch.
Venöse Thrombektomie: bei Patienten mit einer < 7 Tage alten ilio-femoralen Thrombose, bei kontraindizierter Thrombolyse, bei Phlegmasia coerulea dolens.
Patienten, die außerhalb des Krankenhauses an einer Venenthrombose erkranken, haben nur selten Begleitkrankheiten, die eine sofortige stationäre Einweisung erfordern. Dank großer randomisierter Studien gegen Ende der Neunzigerjahre hat sich das Prinzip der ambulanten Thrombosetherapie – bei erhaltener Mobilität des Patienten – auf breiter Basis durchgesetzt. Auch und gerade Befürchtungen hinsichtlich gravierender Komplikationen unter ambulanter Behandlung trafen nicht zu. Alle Schritte der akuten Thrombosetherapie können von erfahrenen niedergelassenen Ärzten suffizient durchgeführt werden.
Literatur:Deutsche Gesellschaft für Angiologie. S2-Leitlinie Diagnostik und Therapie der Venenthrombose und der Lungenembolie. Juni 2010. AWMF-Leitlinien-Register Nr. 065/002.Kearon C, Kahn SR, Agnelli G, Goldhaber S, Raskob GE, Comerota AJ: Antithrombotic therapy for venous thromboembolic disease: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest 2008; 133: 454S – 545S.Baars T, Erbel R: Internistische Notfall- und Intensivmedizin. Köln: Deutscher Ärzteverlag. 1. Aufl. 2011Kelm M, Lauer T: Thrombophlebitis, Venenthrombose und Lungenembolie. In: Schoenenberger RA, Haefeli WE, Schifferli J (Hrsg): Internistische Notfälle. Stuttgart, New York: Georg Thieme Verlag, 2009 Hach-Wunderle V: Thromboseneigung: Diagnostik und Therapie. In: Bruhn HD, Hach-Wunderle V, Schambeck CM, Scharf, RE (Hrsg). Hämostaseologie für die Praxis. Stuttgart: Schattauer, 2. Aufl. 2011Greinacher A , Lubenow N, Hinz P, Ekkernkamp A: Heparininduzierte Thrombozytopenie. Dtsch Ärztebl 2003; 100: 2220 – 2229
Autor
Clemens Bilharz, Facharzt für Anästhesie und Intensivmedizin, Stuttgart
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.