
- DAZ.online
- DAZ / AZ
- DAZ 36/2011
- Universeller ...
Influenza
Universeller Grippeimpfstoff: one shot fits all?
Alle Jahre wieder gibt die Weltgesundheitsorganisation (WHO) im Februar die Zusammensetzung des Influenza-Impfstoffes für die folgende Grippesaison bekannt. Dass dies nötig ist, liegt daran, dass das Genom der Grippeviren aus acht einzelsträngigen RNA-Segmenten besteht, die bei der Virusvermehrung über eine virale, sehr fehlerhaft arbeitende RNA-Polymerase vervielfältigt werden müssen. Dadurch unterscheiden sich die Nachkommenviren immer geringfügig vom dem Virus, das die Infektion verursacht hat. Diese Varianz reicht aus, die Waffen des Immunsystems gegen das Pathogen ins Leere laufen zu lassen.
Suche nach relevanten Influenza-Stämmen
Um möglichst schnell auf die zirkulierenden Varianten reagieren zu können, sammelt das Global Influenza Surveillance Network (GISN) der WHO das ganze Jahr über die epidemiologischen und virologischen Daten zur Grippe und sagt mit einer recht guten Trefferwahrscheinlichkeit die zukünftig relevanten Influenzastämme vorher. Es wird also jedes Jahr neuer Impfstoff gegen die Influenza hergestellt, und jeder, der sich effizient vor der Grippe schützen will, muss sich alljährlich irgendwann zwischen September und November neu impfen lassen.
Niedrige Durchimpfungsrate
Obwohl die Impfung wirklich nebenwirkungsarm ist und einen guten Schutz bietet, ist die Durchimpfungsrate in der Bevölkerung so niedrig, dass die WHO die jährliche globale Krankheitsbelastung auf bis zu eine Milliarde Infektionen schätzt, wobei es bei 3 bis 5 Millionen Infizierten zu schweren Erkrankungen kommt und zwischen 300.000 und 500.000 Menschen an der Infektion sterben [1]. Vielleicht könnte man der Impfmüdigkeit mit einem Impfstoff begegnen, der nur einmal verabreicht für mehrere Jahr(zehnt)e gegen eine Vielzahl von Virus-Varianten schützt. Vielversprechende Veröffentlichungen in diese Richtung sind bereits erschienen, und erst kürzlich haben zwei Publikationen in Science Express wieder für Aufsehen gesorgt.
Derzeit zugelassene Influenza-Impfstoffe
Die für Impfstoffe zuständige Zulassungsbehörde, das Paul-Ehrlich-Institut in Langen, veröffentlich alljährlich eine Liste mit den in Deutschland verkehrsfähigen Influenza-Impfstoffen (www.pei.de). Und wer sich regelmäßig gegen die Grippe impfen lässt, kann in seinem Impfpass nachlesen, dass er/sie mit einem inaktivierten Virusimpfstoff immunisiert wurde, der entweder als Untereinheiten- oder aber als Spalt-Impfstoff klassifiziert wird. Während Spaltimpfstoffe so definiert sind, dass sie zusätzlich zu den Oberflächenantigenen Hämagglutinin und Neuraminidase weitere virale Proteine enthalten, bestehen die Untereinheiten-Impfstoffe nur aus den hochgereinigten Proteinen Hämagglutinin und Neuraminidase [2]. Interessanterweise findet man auf der Liste der verkehrsfähigen Grippeimpfstoffe mit InfectoVac® Flu und Inflexal® V auch zwei virosomal formulierte, inaktivierte Virusimpfstoffe. Bei dieser Art Impfstoff sind die gereinigten Oberflächenproteine wieder in eine Virushülle integriert, so dass ein Viruspartikel vorgetäuscht wird, das sich jedoch wegen der fehlenden Nukleinsäuremoleküle nicht vermehren kann. Ähnlich wie die Untereinheiten- oder Spalt-Impfstoffe kann auch ein virosomal formulierter Impfstoff bei Erwachsenen und Kindern ab dem 6. Lebensmonat eingesetzt werden.
Erst seit Januar 2011 ergänzt mit Fluenz® ein nasal anzuwendender Impfstoff mit lebendattenuierten, Kälte-adaptierten Viren das Spektrum der Influenza-Impfstoffe. Für diese Impfstoffentwicklung werden rekombinante VERO-Zellen verwendet, also eine Nierenzelllinie der Grünen Meerkatze, die ganz gezielt Gensegmente von solchen Influenzaviren enthalten, die sich nur bei 25° C ausschließlich in den oberen Atemwegen und zudem auch noch recht ineffizient vermehren können. Zusätzlich erhalten diese Zellen noch die Gensegmente, die für die Neuraminidase bzw. das Hämagglutinin der saisonal empfohlenen Virusstämme codieren. Fluenz® ist als Nasenspray und nur bei Kindern und Jugendlichen ab 24 Monaten bis zum vollendeten 18. Lebensjahr anzuwenden. Bei Erwachsenen erwies sich dieser Impfstoff erstaunlicherweise als nicht ausreichend effizient [3].
Neue Immunisierungsstrategien
Trotz dieser recht üppigen Impfstoffpalette wird auch nach alternativen Strategien zur Immunisierung gesucht. Als Alternative zu bisher eingesetzten Virosomen-Impfstoffen lassen sich andere virale Vektoren verwenden, die Gene für schützende Influenza-Proteine enthalten, so dass diese Proteine dann auf der Oberfläche der Viren exprimiert werden. Hierzu werden als Basis Vaccinia- oder auch Adenoviren verwendet, deren Vorteil darin besteht, dass sie eine effiziente Immunantwort zytotoxischer T-Zellen induzieren, die infizierte Zellen effizient attackieren [4].
Eine bereits seit Längerem beforschte Immunisierungsvariante ist die Prime/Boost-Strategie, die übrigens auch zur Verhütung einer HIV-Infektion getestet wird. Hierbei wird zunächst Plasmid-DNA verabreicht, die im Fall einer Influenza-Impfung für Hämagglutinin codiert. Nach vier Wochen folgt dann eine normale Impfung mit einem trivalenten, saisonalen Influenza-Impfstoff. In Mäusen und Frettchen konnte so eine Immunantwort induziert werden, die vor einer Infektion mit verschiedenen Varianten des Influenza-A-Virus-Subtyps H1N1 schützte. Allerdings ist die Subtyp-Spezifität des Schutzes vom Typ des verwendeten Hämagglutinin-Gens abhängig, so dass diese Variante nicht als universeller Impfstoff taugt [5].
Hochkonservierte Antigene der Influenzaviren
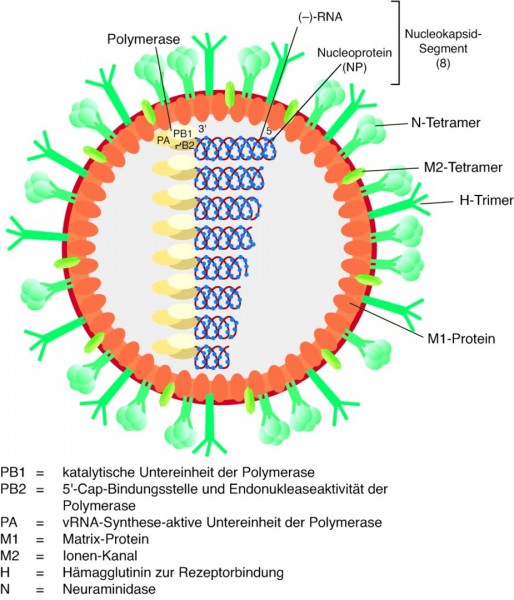
Bisher werden immer die viralen Oberflächenantigene Neuraminidase und vor allem Hämagglutinin (Abb. 1) für die Immunisierung verwendet, da sie in der Lage sind, die Bildung neutralisierender Antikörper zu induzieren. Allerdings sind gerade diese Proteine extrem variabel. Eine Immunantwort, die vor möglichst vielen unterschiedlichen Virus-Subtypen schützt, sollte dagegen durch ein Antigen induzierbar sein, das bei unterschiedlichen Virus-Typen möglichst konserviert vorliegt. Bisher wurden zwei heiße Kandidaten für eine derartige Strategie genauer untersucht: die Ectodomäne des M2-Proteins (eM2) und das N-terminale Fusionspeptid mit den Aminosäuren 1 bis 38 des Hämagglutinins (HA2).
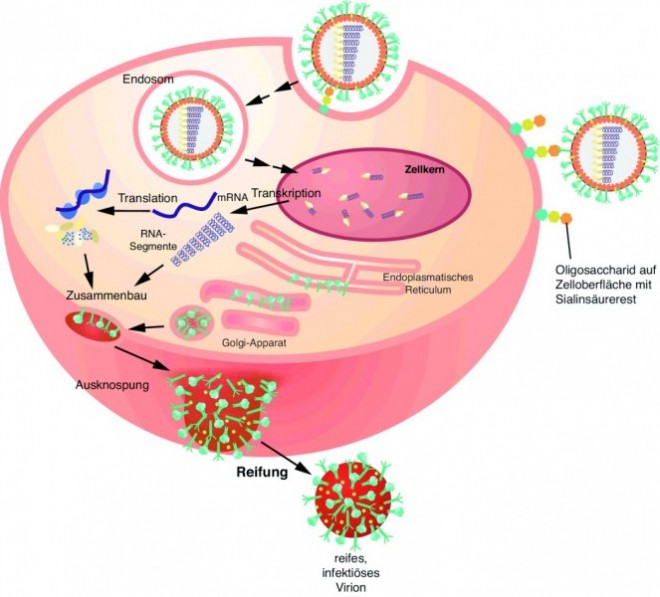
M2-Ectodomäne. Das 97 Aminosäuren lange M2-Protein bildet als Homotetramer einen Ionenkanal in der Virushülle und ist für das Uncoating des Viruspartikels aus dem Endosom der infizierten Zelle verantwortlich (Abb. 2). Wie wichtig M2 für den Infektionszyklus ist, zeigt sich an der spezifischen Inhibition durch z. B. Amantadin sowie daran, dass Antikörper gegen M2 die Virusvermehrung verhindern können. Erstaunlicherweise konnte man beim Vergleich der M2-Sequenzen verschiedener Influenza-A-Viren sehen, dass die ersten 23 Aminosäuren, die die sogenannte Ectodomäne des M2-Proteins bilden und auf der Virusoberfläche exponiert sind, extrem konserviert sind. Deshalb bietet sich eigentlich gerade dieser Bereich als universelles Antigen an. Um die Immunogenität des kurzen Peptids zu erhöhen und die Struktur des M2-Proteins zu imitieren, wurde die Ectodomäne mittlerweile mit verschiedenen Proteinen fusioniert [6, 7]. Mit ACAM-FLU-A wird beispielsweise ein rekombinantes Fusionsprotein klinisch getestet, das aus der M2-Ectodomäne und dem Hepatitis-B-core-Protein besteht. Der Hepatitis-B-core-Anteil bildet Virus-ähnliche Partikel aus, die dann wiederum die M2-Ectodomäne optimal exponieren [6]. VAX102 (Synonym: STF2.4xM2e) ist ebenfalls ein rekombinantes Fusionsprotein in klinischer Testung, das aus vier hintereinander gesetzten M2-Ectodomänen besteht. Dieses Peptid-Tandem ist wiederum an den C-Terminus des Flagellins aus Salmonella typhimurium (STF2) fusioniert. Über den Flagellin-Teil wird der Toll-like-Rezeptor 5 auf dendritischen Zellen aktiviert, wodurch sehr effizient das angeborene und in Folge auch das adaptive Immunsystem stimuliert werden [7].
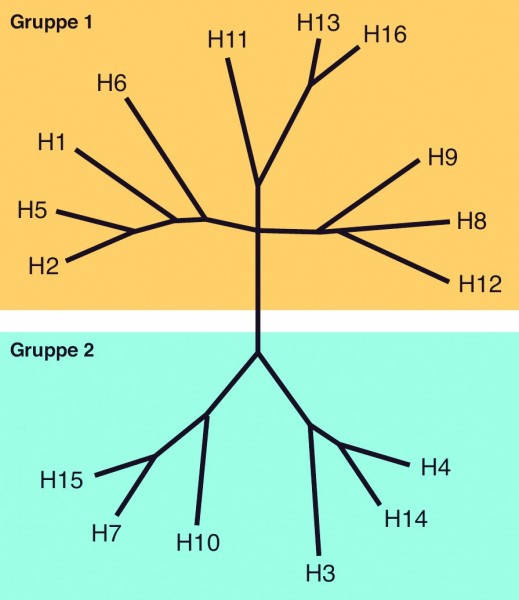
Stammregion des Hämagglutinins. Hämagglutinin (HA) ist das dominante Oberflächenglykoprotein der Influenza-Viren und DAS Antigen für neutralisierende Antikörper schlechthin. Inzwischen kennt man 16 verschiedene HA-Subtypen, die in zwei unterschiedliche Gruppen eingeteilt werden (Abb. 3). Das zunächst ca. 565 Aminosäuren lange Protein wird von Wirtszellproteasen in die beiden Untereinheiten HA1 und HA2 gespalten und als Homotrimer in die Membran eingelagert. Während HA1 den sehr variablen Glykoprotein-Kopf bildet und für die Bindung des Viruspartikels an die Zielzelle verantwortlich ist, bildet HA2 eine Art Stammregion in Richtung Membran aus und führt nach einer Konformationsänderung zur Fusion von Virus-Hüllmembran und Endosomenmembran der Wirtszelle und dadurch zur Freisetzung der viralen Nukleinsäure. Die N-terminalen Aminosäuren von HA2, das sogenannte Fusionspeptid, sind extrem konserviert zwischen den verschiedenen Hämagglutininen. Verschiedene Forschergruppen konnten aus Phagen-Antikörperbanken oder humanem Serum Antikörper isolieren, die in der Lage sind, an diese konservierte Region zu binden und entsprechende Virus-Subtypen zu neutralisieren [8 – 11]. Damit stehen einerseits Antikörper zur Verfügung, die im akuten Pandemiefall in Form einer passiven Immunisierung die schnelle Ausbreitung des Pandemievirus unterbinden können. Zum anderen kann über die genaue Analyse der Bindungsstelle ein konserviertes Antigen identifiziert werden, das vielleicht bald als universeller Impfstoff gegen Influenza eingesetzt werden kann.
M2-Ectodomäne oder HA2-Fusionsprotein oder noch was ganz anderes? Welches der beiden hoch-konservierten Influenza-Antigene ist nun der Favorit? In einer direkten Vergleichsstudie von entsprechenden Peptidkonjugaten mit dem Schneckenprotein Keyhole-Limpet-Hemocyanin (KLH) in Mäusen zeigte es sich, dass eM2 einen besseren Immunschutz induzierte als das HA2-Fusionspeptid und dass diese Immunantwort auch gegen ein breites Spektrum von Virussubtypen schützte [12]. Vielleicht wäre ja eine Kombination aus beiden Peptiden der Impfstoff der Wahl.
Nach wie vor wird aber vor allem auf die Induktion neutralisierender Antikörper geschaut und weniger auf eine zelluläre Immunantwort durch zytotoxische T-Zellen. Gerade die internen Influenza-Antigene, wie das Nucleoprotein oder aber auch das Matrixprotein M1, sind Proteine, die zwischen den Virus-Subtypen extrem konserviert sind. Allerdings können sie als "Kryptotope" keine Rolle für die Infektabwehr durch Antikörper spielen. Sie können aber die Bildung zytotoxischer T-Zellen induzieren, die zwar keine Influenza-Infektion verhindern, sehr wohl aber den Krankheitsverlauf positiv beeinflussen können.
Gibt es bald den universellen Influenza-Impfstoff?
Es wird viel geforscht auf dem Gebiet der Influenza-Impfstoffe, und es gibt viele interessante Ansätze, seien es alternative Antigene, alternative Formulierungen oder alternative Immunisierungsstrategien. Diese verschiedenen Ansätze lassen sich im Prinzip beliebig kombinieren und austesten. Etliche Ansätze zeigten bereits in Tierversuchen an Mäusen, Frettchen oder Kaninchen vielversprechende Ergebnisse. Allerdings lassen sich z. B. Mäuse deutlich einfacher gegen Influenza immunisieren als Menschen, so dass es fraglich ist, ob die Ergebnisse aus den Tierversuchen wirklich auf den Menschen übertragbar sind. Erschwerend kommt hinzu, dass die beim Menschen in klinischen Studien beobachteten Effekte in den meisten Fällen aus einer Kombination der aktuellen Impfung und bereits früher erfolgter Immunisierungsreaktionen – sei es nach einer durchlittenen Grippe oder nach einer oder mehreren Impfungen mit einem zugelassenen interpandemischen Impfstoff – resultieren. So bleibt oft unklar, ob die Effekte der Impfung auf einer Reaktivierung bereits vorhandener Gedächtniszellen oder einer neuinduzierten Immunität beruhen [13].
Schließlich bleibt abzuwarten, ob die pharmazeutische Industrie das Konzept eines universellen Antigens gegen Influenzaviren aufgreifen würde, wohl wissend, dass dadurch das lukrative Geschäft der jährlichen Immunisierung mit einem angepassten interpandemischen Impfstoff einbrechen würde.
Im Pandemiefall könnten aber zumindest ad hoc die bereits identifizierten, gegen verschiedene Virus-Subtypen neutralisierend wirkenden Antikörper als passive Immunisierung eingesetzt werden.
Literatur
[1] Lambert L, Fauci AS: Influenza Vaccines of the Future. NEJM 2010; 363: 2036 – 2044
[2] Neumeier E: Grippeimpfstoff-Herstellung in Hühnereiern. PharmuZ 2011; 40:136 – 139
[3] http://www.ema.europa.eu; EPAR Fluenz®
[4] Berthoud TK et al.: Potent CD8+ T-Cell Immunogenicity in Humans of a Novel Heterosubtypic Influenza A Vaccine, MVA– NP1M1. Clin Infect Dis 2011; 52:1 – 7
[5] Wei CJ et al: Induction of Broadly Neutralizing H1N1 Influenza Antibodies by Vaccination. Science 2010; 329: 1060 – 1064
[6] Neirynck S et al.: A universal influenza A vaccine based on the extracellular domain of the M2 protein. Nat Med 1999; 10: 1157 – 1163
[7] Huleatt JW et al.: Potent immunogenicity and efficacy of a universal influenza vaccine candidate comprising a recombinant fusion protein linking influenza M2e to the TLR5 ligand flagellin. Vaccine 2008; 26: 201 – 214
[8] Sui J et al.: Structural and functional bases for broad-spectrum neutralization of avian and human influenza A viruses. Nat. Struct. Mol. Biol. 2009;16: 265 – 273
[9] Ekiert DC et al.: Antibody recognition of a highly conserved influenza virus epitope. Science 2009; 324: 246 – 251
[10] Ekiert DC et al.: A Highly Conserved Neutralizing Epitope on Group 2 Influenza A Viruses. Sciencexpress 7. Juli 2011
[11] Corti D et al.: A Neutralizing Antibody Selected from Plasma Cells That Binds to Group 1 and Group 2 Influenza A Hemagglutinins. Sciencexpress 28. Juli 2011
[12] Stanekova Z et al.: Heterosubtypic protective immunity against influenza A virus induced by fusion peptide of the hemagglutinin in comparison to ectodomain of M2 protein. Acta Virologica 2011; 55: 61 – 67
[13] Dormitzer et al.: Influenza vaccine immunology. Immunol Rev 2011; 239: 167 – 177
Autoren
Dr. Ilse Zündorf, Prof. Dr. Theodor Dingermann, Institut für Pharmazeutische Biologie, Biozentrum, Max-von-Laue-Str. 9, 60438 Frankfurt/Main


















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.