
- DAZ.online
- DAZ / AZ
- DAZ 27/2009
- Nifedipin-Retardtabletten...
Technologie
Nifedipin-Retardtabletten mit unterschiedlicher Galenik
Es wurden verschiedene galenische Konzepte zur Retardierung von Nifedipin entworfen [6].
Weil Nifedipin in Wasser schlecht löslich ist (~10 µg/ml), werden Nifedipin-Retardtabletten mit hydrophilen Polymeren (Hydrogel) hergestellt, die den Wirkstoff hauptsächlich durch Erosion von gequollenen Tablettenschichten freisetzen [7].
Weiterhin wurde ein Gastrointestinales Therapeutisches System (GITS) zur einmal täglichen Applikation entwickelt, das auf der osmotischen Push-Pull-Technologie beruht (in Adalat® OROS, in Deutschland nicht im Handel).
Gefahr des "dose dumping"
Aufgrund ihrer oft hohen Wirkstoffbeladung sind an Retardpräparate besonders hohe Anforderungen bezüglich der Sicherheit und Zuverlässigkeit zu stellen, um die Gefahr eines "dose dumping", also einer ungewollt hohen Wirkstofffreisetzung in kurzer Zeit, auszuschließen. Das Amerikanische Arzneibuch enthält bereits eine Monographie über Nifedipin-Retardpräparate, in der konkrete Anforderungen an die pharmazeutische Verfügbarkeit der Präparate unter In-vitro-Bedingungen definiert sind. Die aktuellen Richtlinien der FDA fordern zudem für Retardpräparate Bioäquivalenzstudien unter prä- und postprandialen Bedingungen [8].
Im Fall von Nifedipin-Retardpräparaten ist ein dose dumping am häufigsten durch die Arzneiform selbst bedingt [9, 10]. Der Grund hierfür kann eine hohe mechanische Belastung der Arzneiform im Magen-Darm-Trakt sein. Weiterhin kann der Einfluss der variablen physikochemischen Eigenschaften des Speisebreis und der Verdauungssäfte wie der pH-Wert, die Ionenstärke oder die Grenzflächenaktivität die Retardierungsprinzipien der Arzneiformen beeinträchtigen und schlimmstenfalls in ein dose dumping münden. Zudem können außergewöhnlich hohe Plasmaspiegelspitzen lange nach der Einnahme eines Retardpräparats nach einer Mahlzeit auftreten, wenn aufgrund einer langen Verweildauer der Arzneiform im Magen eine große Wirkstoffmenge im Magen freigesetzt und danach relativ schnell resorbiert wurde [11, 12].
Interessanterweise wurde für Nifedipin-Retardarzneiformen ein therapeutisch unerwünschtes Wirkstoffabgabeverhalten bisher nur für Tabletten mit hydrophilen Polymeren berichtet, besonders wenn die Einnahme nach einer Mahlzeit erfolgte. Dagegen werden nach Gabe von Adalat® OROS auch unter postprandialen Bedingungen keine besonderen Fluktuationen der Plasmaspiegel beobachtet [11–14]. Diese Beobachtungen weisen darauf hin, dass die beobachteten klinisch relevanten Unterschiede im Wirkstoffabgabeverhalten der Präparate arzneiformbedingt sind und nicht ausschließlich auf der Physiologie der Magenentleerung beruhen.
Prüfpräparate
Gegenstand dieser Arbeit war es, vier Nifedipin-Retardpräparate unterschiedlicher Galenik hinsichtlich ihres In-vitro-Freisetzungsverhaltens zu charakterisieren:
- die Hydrogel-Matrixtabletten Nifedipin Sandoz retard 30 mg und 60 mg sowie
- die GITS Adalat® OROS 30 mg und 60 mg.
Die Präparate wurden vom holländischen Markt bezogen, weil sie in Deutschland nicht verfügbar sind. Die In-vitro-Tests erfolgten unter Standardbedingungen sowie unter physiologisch relevanter mechanischer Belastung, die mithilfe eines biorelevanten Freisetzungstestgerätes neuerdings simuliert werden kann [15].
Wirkstofffreisetzung unter Standardbedingungen
Die Standarduntersuchung der Wirkstofffreisetzung erfolgte unter Verwendung der Blattrührerapparatur (USP Apparatus II) bei einer Temperatur von 37 °C sowie einer Rührgeschwindigkeit von 100 UpM. Die Tests erfolgten unter Lichtausschluss an jeweils zwölf Arzneiformen.
Als Freisetzungsmedien wurden verwendet:
HCl-Lösung pH 1,0, USP Acetatpuffer pH 4,5, USP Phosphatpuffer pH 6,8 und USP pH 8,0.
Aufgrund der schlechten Löslichkeit des Nifedipins wurde den Freisetzungsmedien 1% (w/v) Natriumdodecylsulfat (SDS) zugesetzt, was es erlaubt, Sink-Bedingungen zu gewährleisten.
Zusätzlich wurde das Freisetzungsverhalten beider Formulierungen bei 50 UpM in Phosphatpuffer
pH 6,8 untersucht.
Die Ähnlichkeit der Freisetzungsprofile beider Präparate im jeweiligen Medium wurde anhand der Kalkulation von f2-Werten ermittelt.
Wirkstofffreisetzung unter Stressbedingungen
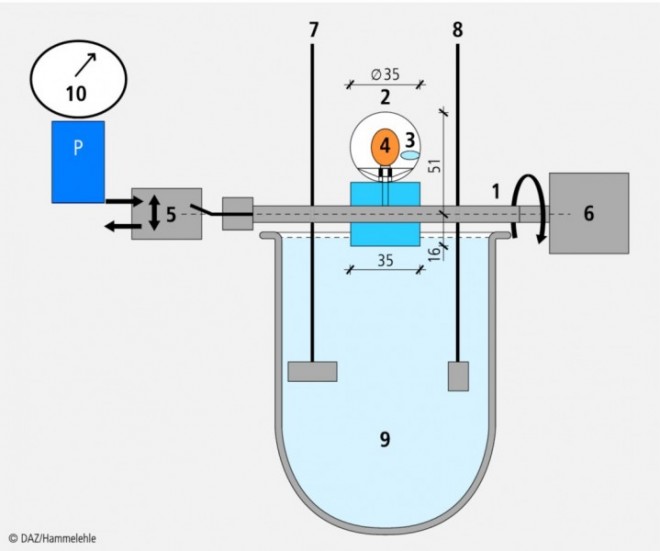
Die mechanische Belastung einer Arzneiform während der Magen-Darm-Passage, die zum Beispiel durch intensive und inhomogene Transportvorgänge, aber auch durch die gastrointestinalen Drücke zustande kommt, kann ihr Freisetzungsverhalten kritisch beeinflussen. Das biorelevante Freisetzungstestgerät bietet die Möglichkeit, mit realer Intensität die physiologischen Transport- und Druckverhältnisse im Gastrointestinaltrakt zu simulieren (Abb. 1) [15].
Das Gerät besteht aus einer rohrförmigen Welle, an deren gegenüberliegenden Enden ein Druckregulationsmodul bzw. ein Schrittmotor angeschlossen sind. An der Welle sind sechs kugelförmige Körbchen aus Drahtgeflecht befestigt (Probengefäße). In der Mitte der Körbchen befindet sich jeweils eine Düse mit einem daran befestigten Ballon, der durch Auf- und Abpumpen die Simulation von peristaltischen Drücken ermöglicht. Die Parameter der Druckwellen (Anzahl, Dauer und Zeitpunkte ihres Auftretens) werden über ein computergesteuertes Ventil bestimmt.
Der Schrittmotor versetzt die Welle in eine genau gesteuerte Rotationsbewegung. Dabei werden die Körbchen abwechselnd durch das Gefäß mit dem Freisetzungsmedium sowie durch die Luft bewegt. Die Arzneiformen bewegen sich mit und stoßen dabei gegen die Körbchenwände, was zu hohen Scherkräften und mechanischem Abrieb führt.
In der vorliegenden Studie wurde das Testgerät in einfachen Sequenzen gesteuert, die geeignet sind, maximal auftretende physiologische Stressereignisse zu imitieren. Die Rotationssequenzen bestanden aus einminütigen Rotationsphasen mit einer Drehzahl von 100 UpM, die in der Sequenz 1 alle 19 min und in der Sequenz 2 alle 59 min auftraten. In den Sequenzen 3 und 4 wurden die Arzneiformen Druckbelastungen ausgesetzt, die einmal pro 20 min (Sequenz 3) bzw. einmal pro 60 min (Sequenz 4) auftraten. Die Druckereignisse bestanden jeweils aus drei symmetrischen Druckwellen von 300 mbar und 6 s Dauer.
Als Freisetzungsmedien im Stresstest diente Pharm. Eur. Phosphat-Pufferlösung pH 6,8 mit Zusatz von 1% SDS (w/v) bei einer Temperatur von 37 °C; das Freisetzungsgefäß hatte ein Füllvolumen von 1200 ml.
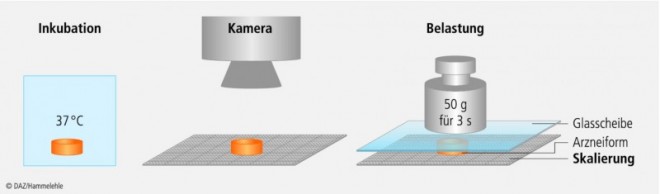
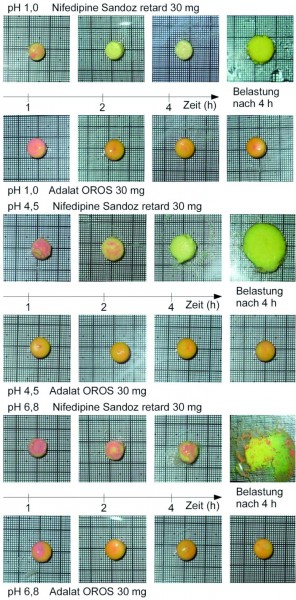
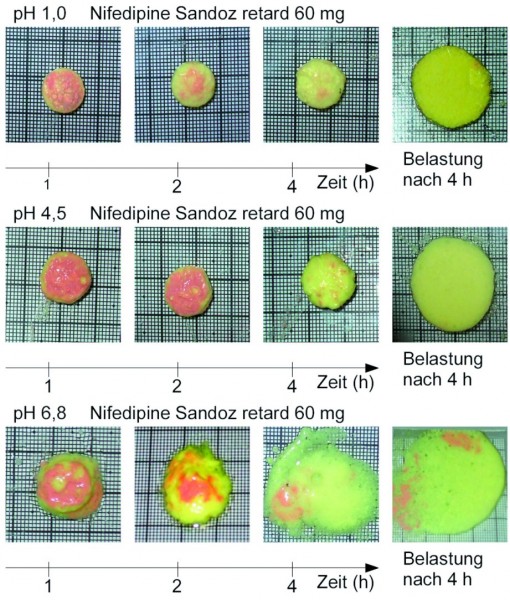
Belastungstest
Um die pH-Abhängigkeit des Quellverhaltens und der mechanischen Beständigkeit der Arzneiformen in visualisierbarer Form zu untersuchen, wurden diese in den Freisetzungsmedien mit den pH-Werten pH 1,0, pH 4,5 und pH 6,8 für eine Zeit von 1 h, 2 h und 4 h bei 37 °C inkubiert (Abb. 2). Danach wurden die Arzneiformen aus dem Medium entnommen, auf eine skalierte PVC-Platte gelegt und fotografiert. Nach der letzten Inkubation wurden sie zusätzlich mit einer Glasscheibe (Masse < 5 g) bedeckt, auf welche eine Last von 50 g für die Dauer von 3 s aufgebracht wurde. Dies entspricht Drücken, die im Gastrointestinaltrakt auftreten [17]. Anschließend folgte eine weitere Fotografie, die zeigt, ob ein harter, nicht hydratisierter Kern in der Arzneiform vorhanden ist.
Ergebnisse
- Standardfreisetzungstests
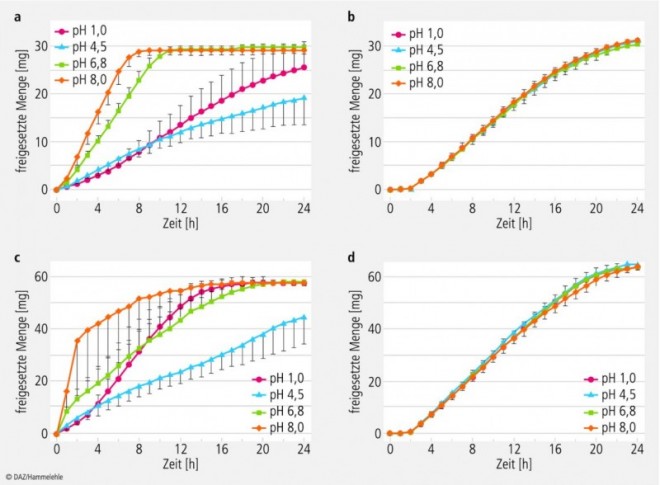
Die Ergebnisse der Standardfreisetzungstests sind in den Abbildungen 3 und 4 dargestellt.
Die Freisetzungscharakteristik von Adalat® OROS 30 mg und 60 mg wird durch den pH-Wert der Freisetzungsmedien und durch die Rührgeschwindigkeit kaum beeinflusst. Die Freisetzung beginnt nach einer für OROS-Systeme charakteristischen Verzögerungszeit (lag time) von etwa zwei Stunden mit einer nahezu konstanten Rate und ist nach etwa 23 h beendet.
Dagegen ist das Freisetzungsverhalten der Nifedipin Sandoz 30 mg Tabletten deutlich pH-abhängig. Die höchste Freisetzungsrate von etwa 3,3 mg/h Nifedipin tritt in dem Freisetzungsmedium mit pH 8,0 auf; dort wird die komplette Wirkstoffmenge innerhalb von etwa 8 h freigesetzt. Der langsamste Verlauf mit einer Freisetzung von etwa 19,2 mg Nifedipin in 24 Stunden ist in Acetatpuffer pH 4,5 zu beobachten. Anhand der Standardabweichungen ist ersichtlich, dass hier die einzelnen Freisetzungsverläufe wesentlich stärker vom Mittelwert abweichen als bei den OROS-Tabletten.
Die Nifedipin Sandoz 60 mg Tabletten weisen ebenfalls eine starke ausgeprägte pH-Abhängigkeit des Freisetzungsverhaltens auf. Auch hier ist die Freisetzungsrate in Acetatpuffer pH 4,5 am niedrigsten und langsamsten (25,8 mg Wirkstoff in 24 h) und im Medium mit pH 8,0 am schnellsten.
Bei Adalat® OROS veränderte die Reduzierung der Drehzahl von 100 UpM auf 50 UpM nicht den Freisetzungsverlauf (Abb. 4). Dagegen weisen die Sandoz-Tabletten bei reduzierter Drehzahl in USP Phosphatpuffer pH 6,8 ein unvollständiges Auflösungsverhalten und eine Verminderung der Freisetzungsrate auf.
Die Ähnlichkeitsanalyse der Freisetzungsprofile beider Arzneiformen ergab in acht von zehn Fällen f2-Werte unter 50, was bedeutet, dass die Testergebnisse nicht vergleichbar sind. Nur die Freisetzungsprofile der 60 mg Tabletten in USP Phosphatpuffer pH 6,8 bei 100 UpM sowie der 30 mg Tabletten im selben Medium bei 50 UpM sind vergleichbar (siehe Tabelle).
Tab.: Vergleich der Ergebnisse von Adalat OROS 30 mg/
Der Ähnlichkeitsfaktor f2 ist ein Maß für die Vergleichbarkeit der jeweiligen Ergebnisse. | |||
| Wirkstärke | pH-Wert/Drehzahl | f2 | Testergebnis |
| 30 mg | pH 1 /100 UpM | 42 | nicht vergleichbar |
| pH 4,5/100 UpM | 30 | nicht vergleichbar | |
| pH 6,8/ 50 UpM | 50 | vergleichbar | |
| pH 6,8/100 UpM | 26 | nicht vergleichbar | |
| pH 8 /100 UpM | 20 | nicht vergleichbar | |
| 60 mg | pH 1 /100 UpM | 43 | nicht vergleichbar |
| pH 4,5/100 UpM | 18 | nicht vergleichbar | |
| pH 6,8/ 50 UpM | 24 | nicht vergleichbar | |
| pH 6,8/100 UpM | 58 | vergleichbar | |
| pH 8 /100 UpM | 20 | nicht vergleichbar | |
- Stresstests
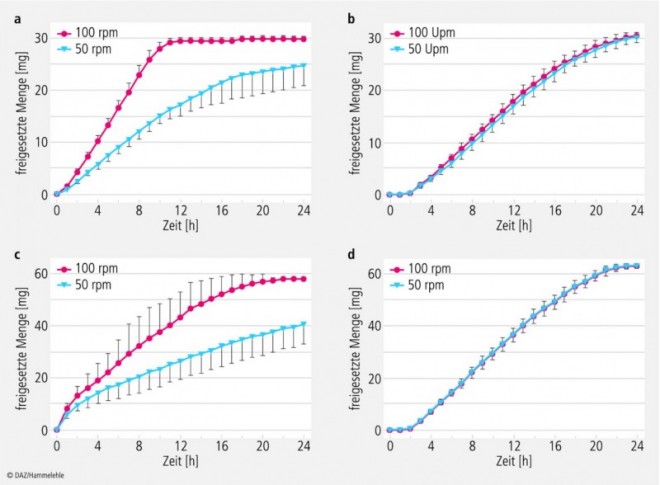
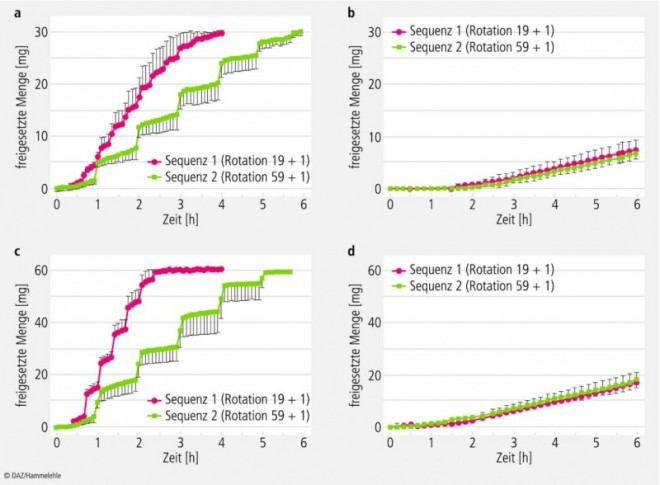
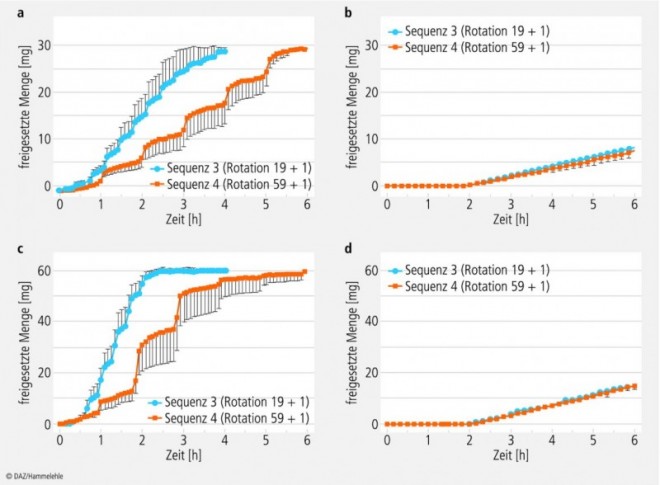
Die Ergebnisse der Stresstests sind in den Abbildungen 5 und 6 dargestellt. Auffällig ist, dass die Freisetzungscharakteristik von Adalat® OROS in beiden Stärken (30 und 60 mg) unter den Stressbedingungen nicht nennenswert verändert wird. Die Freisetzungsraten entsprechen den Ergebnissen der Standardfreisetzungstests.
Bei den Nifedipin Sandoz-Tabletten ist dagegen eine deutliche Veränderung der Freisetzungscharakteristik zu beobachten. Die Stressphasen beschleunigen den Freisetzungsprozess, wobei schnelle Bewegungen und Druckwellen etwa die gleichen Auswirkungen haben. Bei den Sequenzen 1 und 3 (Stressphasen alle 19 bzw. 20 min) wurde eine höhere Freisetzungsrate registriert; der Wirkstoff war bei den 30 mg Tabletten nach ca. 3,5 h und bei den 60 mg Tabletten schon nach ca. 1,5 h vollständig freigesetzt. In den Sequenzen 2 und 4 (nur ein Stressereignis pro Stunde) lagen die Freisetzungszeiten für die Gesamtwirkstoffmengen bei etwa 5 h für beide Wirkstärken.
- Belastungstests
Die Ergebnisse der Belastungstests sind in den Abbildungen 7 und 8 wiedergegeben. Während die OROS-Tabletten sich unter allen Prüfbedingungen als formstabil erwiesen (für OROS 60 mg nicht gezeigt, da identisch mit OROS 30 mg), halten die Hydrogel-Matrixtabletten spätestens nach vier Stunden im Phosphatpuffer pH 6,8 der Belastung von 50 g nicht mehr Stand.
Diskussion
Nifedipin ist ein sehr gut belegtes Beispiel für einen Arzneistoff, bei dem die Geschwindigkeit der Anflutung sowohl für die Wirkung als auch für die Verträglichkeit von großer Bedeutung ist [1 – 6].
Die Steuerung der Anflutungsgeschwindigkeit eines Arzneistoffs im Blutplasma stellt eine klassische Aufgabe einer Retardarzneiform dar. Entsprechend kommt der Galenik bei der zuverlässigen Bewerkstelligung dieser Aufgabe eine essenzielle Bedeutung zu. Im Falle von Nifedipin wird für die Bewältigung dieser Aufgabe auf ganz unterschiedliche Technologien zurückgegriffen, wie beispielsweise die Steuerung der Diffusionsgeschwindigkeit durch Überzugsmaterialien, die Verzögerung der Auflösungsgeschwindigkeit über die Partikelgröße der Wirkstoffkristalle, die Einbettung in quellende hydrophile Matrizes sowie die Freigabesteuerung durch osmotische Systeme.
In den letzten Jahren wurde in mehreren klinischen Studien mit Nifedipin-Retardpräparaten beobachtet, dass nach Einnahme mit Nahrung teilweise drastisch unterschiedliche Plasmaspiegelverläufe resultieren [11 – 14, 16], obwohl die Präparate in Ländern der Europäischen Union als uneingeschränkt austauschbar eingestuft sind. Insbesondere wurden nach Einnahme mit Nahrung bei zahlreichen Präparaten extrem hohe Plasmaspiegelspitzen beobachtet, die auf ein dose dumping – ein Versagen der Retardierung, verbunden mit einer schlagartigen Freisetzung hoher Wirkstoffmengen – hindeuten.
In einer im Jahr 2008 publizierten klinischen Studie mit zwölf Probanden traten solche Plasmaspiegelspitzen nach Einnahme einer Mahlzeit bei dem in den Niederlanden im Handel befindlichen Präparat Nifedipin Sandoz retard 30 mg bei einer ganzen Reihe von Probanden typischerweise vier bis sechs Stunden nach der Einnahme auf [14]. Bei der vergleichend in der Studie untersuchten Darreichungsform Adalat® 30 mg GITS waren derartige Plasmaspiegelspitzen dagegen in keinem Fall zu beobachten.
Die Autoren der Studie diskutieren als Ursache für das dose dumping die von ihnen unter den Standarduntersuchungsbedingungen beobachtete pH-Abhängigkeit der Wirkstofffreisetzung [14].
In unserer Arbeitsgruppe wurde in den letzten Jahren ein biorelevantes Freisetzungstestgerät entwickelt, das es ermöglicht, der physiologischen Situation nachempfundenen physikalischen Stress auf Arzneiformen auszuüben. Dieser Stress wird in Form von als Rotationsbewegungen ausgeführten realitätsnahen Bewegungsmustern mit kurzfristig hohen Beschleunigungswerten und wechselndem Kontakt zwischen der Flüssigkeitsphase und der Gasphase sowie mittels Druckwellen mit für die Peristaltik realistischen Druckamplituden ausgeführt [9, 10, 15].
Es war deshalb unser Ziel zu untersuchen, inwieweit die bei Nifedipin Sandoz 30 mg in einer klinischen Studie beobachteten Plasmaspiegelspitzen gegebenenfalls mit einer unzureichenden Widerstandsfähigkeit gegenüber physiologisch relevantem Stress zu erklären sind. Die erzielten Ergebnisse bestätigen unsere Vermutung. Nifedipin Sandoz retard 30 mg zeigt unter physikalischem Stress im Gegensatz zu Adalat® OROS 30 mg eine drastische Beschleunigung der Freisetzung, die ein dose dumping durch mechanischen Stress während der Verdauung sehr wahrscheinlich macht. Es ist anzunehmen, dass in einer klinischen Studie vergleichbare Befunde zu erwarten wären.
Fazit: Retardpräparate sind nicht beliebig austauschbar
Nach unseren bisherigen Erfahrungen mit dem biorelevanten Freisetzungstestgerät lässt sich feststellen, dass als bioäquivalent und damit austauschbar zugelassene retardierte Darreichungsformen keinesfalls immer pharmazeutisch äquivalent sind. Sofern uns aktuelle Daten aus Bioäquivalenzstudien vorliegen, deckt sich diese Beobachtung in allen von uns untersuchten Fällen auch mit der Beobachtung, dass diese Darreichungsformen zumindest unter postprandialen Untersuchungsbedingungen nicht bioäquivalent sind. Dies spricht einerseits dafür, dass unsere Methode, die physiologische und mechanische Belastung auf Arzneiformen zu simulieren, realitätsnah und damit für die Vorhersage des Verhaltens modifiziert freisetzender oraler Arzneiformen relevant ist.
Andererseits zeigt dieser Befund aber auch, wie zweifelhaft die Annahme einer generellen Austauschbarkeit aller wirkstoffgleichen Darreichungsformen ist.
Danksagung
Wir danken Frau Dr. Kerstin Pauli und Herrn Dr. Erich Brendel von der BayerSchering AG für die Überlassung der Daten aus den Freisetzungsuntersuchungen mit dem Blattrührer.
Literatur
[1] Schwartz A, et al. Pharmacology of calcium antagonists. Am J Cardiol 1985;55(7):3C–7C.
[2] Meredith PA, Elliott HL. Dihydropyridine calcium channel blockers: basic pharmacological similarities but fundamental therapeutic differences. J Hypertens 2004;22(9):1641–1648.
[3] Walley TJ, et al. Pharmacokinetics and pharmacodynamics of nifedipine infusion in normal volunteers. Br J Clin Pharmacol 1987;23(6):693–701.
[4] Soons PA, et al. Intraindividual variability in nifedipine pharmacokinetics and effects in healthy subjects. J. Clin Pharmacol 1992;32:324–331.
[5] Banzet O, et al. Acute antihypertensive effect and pharmacokinetics of a tablet preparation of nifedipine. Eur J Clin Pharmacol 1983;24(2):145–150.
[6] Total CB. Formulation dependent pharmacokinetics – does the dosage form matter for nifedipine? J Cardiovasc Pharm 2004;44(1):82– 86.
[7] Karim A, et al. Food-induced changes in theophylline absorption from controlled-release formulations. Part II. Importance of meal composition and dosing time relative to meal intake in assessing changes in absorption. Clin Pharmacol Ther 1985;38:642– 647.
[8] Guidance for Industry. Food-Effect Bioavailability and Fed Bioequivalence Studies. US Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research (CDER). December 2002.
[9] Garbacz G, et al. Comparison of dissolution profiles obtained from nifedipine extended release once a day products using different dissolution test apparatuses. Submitted.
[10] Garbacz G, Blume H, Weitschies W. Investigation of the Dissolution Characteristics of Nifedipine Extended-Release Formulations Using USP Apparatus 2 and a Novel Dissolution Apparatus. Dissol Technol 2009;16(2).
[11] Schug B, et al. The effect of food on the pharmacokinetics of nifedipine in two slow release formulations: pronounced lag-time after a high fat breakfast. Br J Clin Pharmacol 2002;53(6):582–588.
[12] Schug B, et al. Formulation-dependent food effects demonstrated for nifedipine modified-release preparations marketed in the European Union. Eur J Pharm Sci 2002;15(3):279–285.
[13] Wonnemann M, et al. Significant food interactions observed with a nifedipine modified-release formulation marketed in the European Union. Int J Clin Pharmacol Ther 2006;44(1):38– 48.
[14] Wonnemann M, et al. Comparison of two marketed nifedipine modified-release formulations: An exploratory clinical food interaction study. Clin Ther 2008;30(1):48–58.
[15] Garbacz G, et al. Irregular absorption profiles observed from diclofenac extended release tablets can be predicted using a dissolution test apparatus that mimics in vivo physical stresses. Eur J Pharm Biopharm 2008;70(2): 421– 428.
[16] Blume HH, Schug BS, Brendel E. Sind Nifedipin-Retardpräparate austauschbar? Dtsch Apoth Ztg 2002;142(10): 1192–1204.
[17] Anschütz M, et al. Characterization of the behaviour of alginate-based microcapsules in vitro and in vivo. Int J Clin Pharmacol Ther. In press.
Korrespondierender Autor: Prof. Dr. Werner Weitschies, Ernst-Moritz-Arndt-Universität, Friedrich-Ludwig-Jahn-Straße 17, 17487 Greifswald, werner.weitschies@uni-greifswald.de
1 Rohrförmige Welle,
2 Probengefäß (Körbchen),
3 Arzneiform,
4 Düse mit Ballon,
5 Magnetventil,
6 Motor,
7 Blattrührer,
8 Probenzug,
9 Gefäß mit Freisetzungsmedium,
10 Druckregulationsmodul.
a) Nifedipin Sandoz 30 mg retard,
b) Adalat® OROS 30 mg,
c) Nifedipin Sandoz 60 mg retard,
d) Adalat® OROS 60 mg
(Mittelwerte aus n = 12, mit Standardabweichungen).
a) Nifedipin Sandoz 30 mg retard,
b) Adalat® OROS 30 mg,
c) Nifedipin Sandoz 60 mg retard,
d) Adalat® OROS 60 mg
(Mittelwerte aus n = 12, mit Standardabweichungen).
a) Nifedipin Sandoz 30 mg retard,
b) Adalat® OROS 30 mg,
c) Nifedipin Sandoz 60 mg retard,
d) Adalat® OROS 60 mg
(Mittelwerte aus n = 6, mit Standardabweichungen).
a) Nifedipin Sandoz 30 mg retard,
b) Adalat® OROS 30 mg,
c) Nifedipin Sandoz 60 mg retard,
d) Adalat® OROS 60 mg
(Mittelwerte aus n = 6, mit Standardabweichungen).


















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.