
- DAZ.online
- DAZ / AZ
- DAZ 30/2008
- Phytopharmaka in Europa
Arzneimittelrecht
Phytopharmaka in Europa
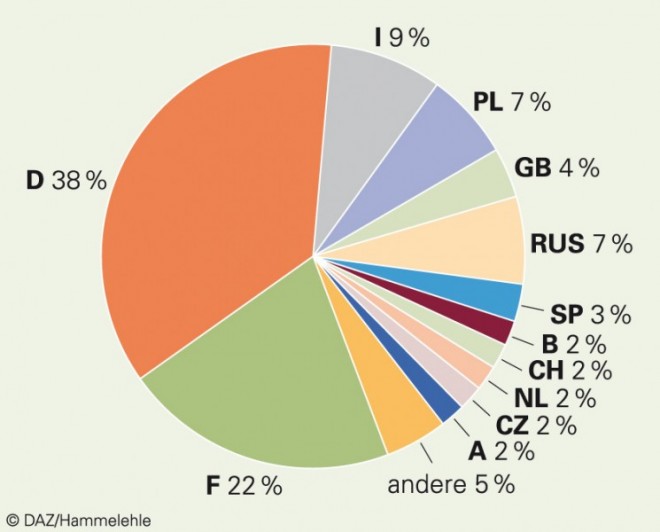
Pflanzliche Arzneimittel besitzen eine lange Tradition in Europa, doch ihre Bedeutung in den einzelnen Ländern ist unterschiedlich. Nach der zuletzt im Jahr 2005 erfolgten Erhebung von IMS International entfallen die größten Anteile des europäischen Marktes auf Deutschland mit 38% und Frankreich mit 22%. Alle anderen Länder befinden sich im einstelligen Prozentbereich, der von Italien mit 9% sowie Polen und Russland mit je 7% angeführt wird (Abb. 1).
Das europäische Zulassungssystem
Im Zuge der stärkeren Vereinheitlichung des europäischen Binnenmarktes ist auch das Arzneimittel-Zulassungssystem durch EG-Recht geregelt. Für Präparate mit Arzneistoffen, deren Wirkungen aufgrund ihrer Anwendung bekannt sind, kommen nach der Richtlinie 2001/83/EG, zuletzt geändert durch die Richtlinie 2004/27/EG,
- das Verfahren der gegenseitigen Anerkennung oder
- das dezentrale Verfahren
in Betracht, je nachdem, ob für das Arzneimittel zum Zeitpunkt der Antragstellung bereits eine Genehmigung vorliegt oder nicht. Bei beiden Verfahren wird eine Arzneimittelzulassung in einem Mitgliedstaat erteilt, die von weiteren Mitgliedstaaten in der Regel anerkannt wird, wenn entsprechende Zulassungsanträge gestellt werden: Die jeweils zuständige Behörde hat auf der Grundlage der Erstzulassung innerhalb einer bestimmten Frist nach Antragsstellung die Zulassung zu erteilen, es sei denn, sie hat begründete Zweifel an der Qualität, Wirksamkeit oder Unbedenklichkeit des Arzneimittels. Kommt es zu keiner Einigung über die strittigen Punkte, wird von zentraler Stelle in einem Schiedsverfahren eine verbindliche Entscheidung gefällt, nach welcher die weitere Zulassung entweder erteilt oder aber endgültig versagt wird, es sei denn, der Zulassungsantrag wird zurückgezogen. Eine solche Versagung hat also eine negative Rückwirkung auf die Erstzulassung.
Das Schiedsverfahren lässt es wünschenswert erscheinen, dass die Kriterien für die Beurteilung pflanzlicher Arzneimittel in den einzelnen Mitgliedstaaten weitgehend übereinstimmen. Eine solche Harmonisierung ist aber derzeit nur ansatzweise erkennbar. Aus diesem Grunde zögern die Hersteller von Phytopharmaka, die Zulassung für ihre Präparate gemäß den europäischen Verfahren zu beantragen. Es gibt erst wenige positiv abgeschlossene Verfahren, z. B. zur Zulassung von Präparaten aus Indischen Flohsamenschalen und Baldrian.
Für Arzneistoffe, die seit längerer Zeit im Markt sind, hatte die Europäische Kommission im Jahr 1999 den Begriff "well-established medicinal use" ("allgemein medizinisch verwendet") neu definiert. Die entsprechenden Arzneimittel können demnach zugelassen werden, wenn der Antragsteller publizierte wissenschaftliche Literatur vorlegt ("bibliographische Zulassung", siehe Kasten).
"Bibliographische Zulassung"Art. 10a der Richtlinie 2001/83/EG:
"… ist der Antragsteller nicht verpflichtet, die Ergebnisse der vorklinischen und klinischen Versuche vorzulegen, wenn er nachweisen kann, dass die Wirkstoffe des Arzneimittels für mindestens zehn Jahre in der Gemeinschaft allgemein medizinisch verwendet wurden und eine anerkannte Wirksamkeit sowie einen annehmbaren Grad an Sicherheit ... aufweisen. In diesem Fall werden die Ergebnisse dieser Versuche durch einschlägige wissenschaftliche Dokumentation ersetzt." |
Die frühere Nachzulassung von Arzneimitteln
Bislang war es in mehreren Mitgliedstaaten möglich, bestimmte Arzneimittel in einem erleichterten Verfahren zuzulassen, beispielsweise in Deutschland durch die Nachzulassung "traditioneller" Arzneimittel nach § 109a AMG. Dies war dadurch begründet, dass frühere Regelungswerke der Europäischen Gemeinschaft keine konkreten Vorgaben über die näheren Modalitäten der nachträglichen Überprüfung des Marktes (nach 1975) enthielten und dass die einzelnen Staaten dazu unterschiedliche Systeme entwickelten. Zudem führten landestypische Traditionen und therapeutische Erfahrungen mit pflanzlichen Arzneimitteln zu unterschiedlichen Bewertungsmaßstäben der nationalen Behörden.
Solche Unterschiede sind ausführlich dargestellt in der Studie über pflanzliche Arzneimittel in der Europäischen Union, die der europäische Verband der Arzneimittel-Hersteller AESGP im Jahr 1998 im Auftrag der Europäischen Kommission durchgeführt hatte. Neben einer Verbesserung der bibliographischen Zulassung für pflanzliche Arzneimittel empfahl die AESGP, solche Arzneimittel besonders zu berücksichtigen, deren Anwendungsgebiete ausschließlich auf traditioneller Anwendung und Erfahrung beruhen. Diese Empfehlung hat der europäische Gesetzgeber in der Richtlinie 2004/24/EG umgesetzt.
Registrierungsverfahren für traditionelle pflanzliche Arzneimittel
Die Richtlinie 2004/24/EG über traditionelle pflanzliche Arzneimittel ist am 30. April 2004 in Kraft getreten. Damit wurde neben den durch ihren "well-established medicinal use" charakterisierten Phytopharmaka eine weitere Gruppe pflanzlicher Zubereitungen im europäischen Arzneimittelrecht verankert. Sie umfasst solche Präparate, die Indikationen für relativ geringfügige Gesundheitsstörungen beanspruchen, definierte Dosisstärken und Anwendungsarten haben (oral, äußerlich oder inhalalativ) sowie eine ausreichende pharmazeutische Qualität und eine belegte Unbedenklichkeit besitzen. Die Wirksamkeit muss auf Grund einer langen medizinischen Anwendung und Erfahrung plausibel sein, wobei eine Dauer von mindestens 30 Jahren – davon mindestens 15 Jahre innerhalb der EU – gefordert wird. In der Kennzeichnung und Werbung muss darauf hingewiesen werden, dass Wirksamkeit und Unbedenklichkeit ausschließlich auf Informationen aus langdauernder Verwendung und Erfahrung beruhen.
Die Richtlinie gilt auch für Kombinationen von pflanzlichen mit bestimmten nicht-pflanzlichen Bestandteilen, zu denen (derzeit) Vitamine und Mineralstoffe zählen, doch soll deren Stellenwert im Präparat den pflanzlichen Bestandteilen untergeordnet ("ancillary") sein.
Im Mai 2007 hat die EU-Kommission eine öffentliche Anhörung zu ihrem Berichtsentwurf über die Erfahrungen mit der Umsetzung der Richtlinie 2004/24/EG eingeleitet. Dieser Bericht soll insbesondere auch zu einer möglichen Ausweitung des Anwendungsbereiches dieser Richtlinie Stellung nehmen. So könnten möglicherweise künftig auch weitere Stoffkombinationen unter den Anwendungsbereich der Richtlinie fallen.
Mit dem neuen Registrierungsverfahren liegen in den einzelnen EU-Mitgliedstaaten erst wenige praktische Erfahrungen vor. Es sind erst wenige Registrierungen für traditionelle pflanzliche Arzneimittel in Deutschland (Tab. 1), Großbritannien (Tab. 2) und Österreich erteilt worden.
Tab. 1: In Deutschland von September 2005 bis Juni 2008 erteilte Registrierungen für traditionelle pflanzliche Arzneimittel | ||
Präparat |
Wirksame Bestandteile |
Registrierung |
Klosterfrau Melissengeist |
Destillat aus 13 Drogen |
Dezember 2005 |
Bad Heilbrunner Weißdorn Tee |
Weißdornblätter mit Blüten |
Februar 2007 |
Canephron®
N Tabletten, - Tropfen |
Liebstöckelwurzel, Tausendgüldenkraut, Rosmarin |
März 2007 |
Granu Fink®
Kapseln |
Kürbissamen, Kürbissamenöl |
Oktober 2007 |
Urophyton®
liquidum |
Queckenwurzelstock-Extrakt |
Januar 2008 |
Tab. 2: In Großbritannien von September 2005 bis Juni 2008 erteilte Registrierungen | ||
Präparat |
Wirksame Bestandteile |
Registrierung |
Atrogel®
|
Arnika-Gel |
Oktober 2006 |
FlexiHerb®
|
Teufelskrallenwurzel-Extrakt |
Januar 2007 |
MigraHerb®
|
Tanacetum-parthenium- Extrakt |
April 2007 |
MenoHerb®
|
Cimicifuga-Extrakt |
Juni 2007 |
Prostasan®
|
Sägepalmen-Extrakt |
September 2007 |
PremHerb®
|
Agnus-castus-Extrakt |
Oktober 2007 |
Nite Herb®
|
Baldrianwurzel-Extrakt |
Dezember 2007 |
Atrosan®
|
Teufelskrallenwurzel-Extrakt |
Januar 2008 |
Hypericalm®
|
Johanniskraut-Extrakt |
Februar 2008 |
Venaforce®
|
Rosskastaniensamen-Extrakt |
Februar 2008 |
Kaloba®
|
Pelargonium-Extrakt |
April 2008 |
Botanova®
|
Extrakte aus Johanniskraut, Baldrianwurzel, Passionsblumenkraut |
Mai 2008 |
Gemessen an der Anzahl der Anträge ist die Anzahl der erfolgreichen Verfahrensabschlüsse als noch nicht zufriedenstellend zu werten. Auch hinsichtlich der Einstufung bestimmter pflanzlicher Zubereitungen in den "well-established medicinal use" oder in den "traditional use" gehen die Auffassungen der nationalen Zulassungsbehörden auseinander. Die britische Gesundheitsbehörde erteilt "traditionelle" Registrierungen für Präparate, die in Deutschland aufgrund der Indikationen als "well-established medicinal use" eingestuft werden (z. B. Johanniskraut-Präparat gegen leichte Depressionen und Angstzustände).
Das europäische Zulassungsverfahren der gegenseitigen Anerkennung (s. o.) kann dann problematisch werden, wenn die beteiligten Zulassungsbehörden sich bei der Einstufung nicht einig sind. Zwar sieht § 39c AMG eine Versagung des Registrierungsantrages nach § 39b AMG vor, wenn für das traditionelle pflanzliche Arzneimittel eine Zulassung gemäß § 21 AMG beantragt ist oder erteilt wurde. Wird jedoch in einem Schiedsverfahren pro "Tradition" entschieden, können die bislang erteilten "well-established medicinal use"-Zulassungen in den anderen Mitgliedstaaten gefährdet sein. Dabei spielt das HMPC eine entscheidende Rolle.
Das Committee on Herbal Medicinal Products (HMPC)
Auf der Basis der Richtlinie 2004/24/EG wurde in der Zulassungsagentur EMEA der Ausschuss für pflanzliche Arzneimittel, das Committee on Herbal Medicinal Products (HMPC), gegründet. Es löst die bislang in diesem Bereich tätige Herbal Medicinal Products Working Party (HMPWP) ab und besteht aus jeweils einem Mitglied und einem Stellvertreter pro Mitgliedstaat und kann maximal fünf zusätzliche Mitglieder kooptieren, die aufgrund ihrer spezifischen wissenschaftlichen Kompetenz für definierte Fachbereiche ausgewählt werden.
Das HMPC hat die Aufgabe, Monographien sowohl für den Bereich des "well-established medicinal use" als auch für den Bereich des "traditional use" zu erstellen. Darüber hinaus ist es beauftragt, eine Liste zu erarbeiten, die pflanzliche Stoffe, pflanzliche Zubereitungen und Kombinationen daraus zur Verwendung in traditionellen pflanzlichen Arzneimitteln enthält. Diese Liste muss für jeden pflanzlichen Stoff das Anwendungsgebiet, die spezifizierte Stärke und Dosierung, den Verabreichungsweg und alle anderen für die sichere Anwendung erforderlichen Informationen enthalten (s. Kasten).
Vom HMPC erstellte Monographien, Monographie-Entwürfe sowie Listenpositionen* (Stand: Juni 2008)
Verabschiedete Monographien
Aloe
Anisi aetheroleum
Anisi fructus (L)
Betulae folium
Calendulae flos (L)
Echinaceae purpureae herba (L)
Eleutherococci radix (L)
Foeniculi amari fructus (L)
Foeniculi amari fructus aetheroleum
Foeniculi dulcis fructus
Frangulae cortex
Lini semen (EL)
Lupuli flos
Melissae folium
Menthae piperitae aetheroleum (EL)
Passiflorae herba
Plantaginis ovatae semen
Plantaginis ovatae seminis tegumentum
Primulae flos
Primulae radix
Psyllii semen
Rhamni purshianae cortex
Rhei radix
Sennae folium
Sennae fructus
Thymi herba
Valerianae radix (EL)
Entwürfe für Monographien
Avenae fructus
Avenae herba
Boldo folium
Equiseti herba
Harpagophyti radix
Meliloti herba
Menthae piperitae folium
Polypodii rhizoma
Rusci aculeati rhizoma
Salicis cortex
Sambuci flos
Solidaginis virgaureae herba
Urticae folium
Urticae herba
Verbasci flos
* L = Verabschiedete Listenpositionen; EL = Entwürfe für Listenpositionen
|
Nicht zuletzt legt das HMPC in Zweifelsfällen fest, ob für eine bestimmte Arzneidroge die Tradition innerhalb Europas ausreicht, beispielsweise wenn diese Pflanze traditionell in der chinesischen Medizin angewendet worden ist.
Arbeitspapiere des HMPC
Das HMPC erarbeitet in mehrmals jährlich stattfindenden, mehrtägigen Sitzungen eine große Anzahl von Leitlinien und weiteren Dokumenten, die sie auf der Website der EMEA (www.emea.europa.eu) publiziert und so den Fachkreisen zugänglich macht. Einige Arbeitspapiere, die für die Beurteilung von Qualität, Wirksamkeit und Unbedenklichkeit pflanzlicher Arzneimittel von großer Bedeutung sind, seien kurz vorgestellt.
Die seit einigen Jahren existierende Leitlinien zur Qualität bzw. zu Spezifikationen pflanzlicher und traditioneller pflanzlicher Arzneimittel (CPMP/QWP/2819/00 Rev 1 bzw. CPMP/QWP/2820/00 Rev 1) sind in einer neuen Fassung publiziert worden. Die bisherigen "Points to Consider on Good Agricultural and Collection Practice (GACP) for Starting Materials of Herbal Origin" (EMEA/HMPC/246816/2005) sind überarbeitet und als Leitlinie des HMPC publiziert worden. Dieses Dokument zur Guten Praxis des Arzneipflanzenanbaus und der Wildsammlung hat empfehlenden Charakter und keine Bindungswirkung im Sinne von GMP, da in vielen Fällen GMP-Regelungen in Verbindung mit der Verpflichtung zur Durchführung behördlicher Inspektionen bei Anbau und Sammlung des Materials in entfernteren Ländern und Erdteilen nicht einzuhalten wären. Gleichwohl trägt es zur Sicherstellung einer hohen und gleichbleibenden Qualität pflanzlicher Arzneidrogen bei.
Die "Guideline on Declaration of Herbal Substances and Herbal Preparations in Herbal Medicinal Products/Traditional Herbal Medicinal Products in the SPC" (EMEA/HMPC/CHMP/CVMP/287539/2005), die viele Regelungen aus Deutschland zur Deklaration pflanzlicher Zubereitungen übernommen hat, ist im Juli 2007 publiziert worden. Durch Anwendung dieser Leitlinie kann eine korrekte und einheitliche Beschreibung pflanzlicher Zubereitungen in Europa erreicht werden.
Die "Guideline on Quality of Combination Herbal Medicinal Products/Traditional Herbal Medicinal Products" (EMEA/HMPC/214869/2006) stellt Ansätze für pragmatische Vorgehensweisen für die Identifizierung und die quantitative Bestimmung pflanzlicher Zubereitungen in Kombinationsarzneimitteln und berücksichtigt hierbei die komplexe Zusammensetzung dieser Arzneimittel. Dazu sind Lösungsmöglichkeiten für solche Fälle aufgezeigt, in denen eine Identitätsprüfung bzw. eine Gehaltsbestimmung eines Kombinationspartners im Fertigarzneimittel nicht möglich ist.
In der "Guideline on the Assessment of Clinical Safety and Efficacy in the Preparation of Monographs for Well-established and of Monographs/Lists for Traditional Herbal Medicinal Products/Substances/Preparations" (EMEA/HMPC/104613/ 2005) sind Anforderungen an den Wirksamkeitsbeleg für Phytopharmaka enthalten. Für den Bereich des "well-established medicinal use" verlangt das Dokument im Allgemeinen mindestens eine kontrollierte klinische Studie von guter Qualität, ersatzweise umfassende klinische Erfahrungen mit dem Arzneimittel und ergänzende humanpharmakologische Daten.
Die "Guideline on the Clinical Assessment of Fixed Combinations of Herbal Substances/Herbal Preparations" (EMEA/HMPC/166326/2005) beschreibt die Anforderungen an die Dokumentation pflanzlicher Kombinationsarzneimittel und unterscheidet hierbei deutlich zwischen dem Bereich des "well-established medicinal use", für die die Kombinationsbegründung auf validen therapeutischen Prinzipien beruhen muss, und traditionellen pflanzlichen Kombinationen, für die die Plausibilität innerhalb des betreffenden Systems der traditionellen Medizin genügt.
Die "Guideline on Non-Clinical Documentation for Herbal Medicinal Products in Applications for Marketing Authorisation (bibliographical and mixed applications) and in Applications for Simplified Registration" (EMEA/HMPC/32116/2005) beinhaltet die Anforderungen an präklinische Untersuchungen für pflanzliche und traditionelle pflanzliche Arzneimittel. Sie geht insbesondere auf das Erfordernis von Studien zur Reproduktionstoxikologie, zur Genotoxizität und zur Kanzerogenität ein. Nach Ansicht der Hersteller sollten allerdings Studien zur Genotoxizität nur gefordert werden können, wenn ein begründeter Verdacht vorliegt. Zur praktischen Implementierung und Interpretation der Anforderungen dieser neuen Leitlinie hat das HMPC eine "Guideline on the Assessment of Genotoxic Constituents in Herbal Substances/Preparations" (EMEA/HMPC/107079/2007) entwickelt, die – in Anlehnung an die ICH-Leitlinie – eine abgestufte Vorgehensweise (Ames-Test, In-vitro- und ggf. In-vivo-Prüfung) enthält.
Ein weiteres Arbeitspapier betrifft das Procedere für Aufrufe des HMPC, wissenschaftliche Daten zur Monographie- bzw. Listenerstellung einzureichen. Gefordert sind bei entsprechenden Aufrufen strategische Angaben zur Literaturrecherche, eine Einteilung in "peer-reviewed"-Publikationen und eine Differenzierung in den "well-established medicinal use" und den "traditional use".
Harmonisierung von Bewertungskriterien durch die ESCOP
Mit dem Ziel, harmonisierte Bewertungskriterien für Phytopharmaka in Europa zu schaffen, war 1989 die ESCOP als Dachorganisation nationaler wissenschaftlicher Fachgesellschaften für Phytotherapie gegründet worden. Ihr gehören heute Fachgesellschaften aus vielen europäischen Ländern an.
Das wissenschaftliche Komitee der ESCOP erstellt seit nunmehr fast 20 Jahren Vorschläge für Monographien zur Wirksamkeit und Unbedenklichkeit von Arzneipflanzen-Zubereitungen, die in ihrer Struktur an die Vorgaben der Leitlinie "Summary of Product Characteristics" angelehnt sind und sich auf die aktuelle wissenschaftliche Literatur stützen. Zuletzt ist im Oktober 2003 eine Publikation der ESCOP mit 60 revidierten und 20 neuen Monographien erschienen (s. Kasten). Ein Ergänzungsband mit ca. 30 neuen bzw. überarbeiteten Texten soll Ende 2008 folgen.
Publizierte ESCOP-MonographienAbsinthii herba Wermutkraut
Agni casti fructus Keuschlammfrüchte
Allii sativi bulbus Knoblauchzwiebel
Aloe Aloe
Althaeae radix Eibischwurzel
Anisi fructus Anis
Arnicae flos Arnikablüten
Betulae folium Birkenblätter
Boldo folium Boldoblätter
Calendulae flos Ringelblumenblüten
Carvi fructus Kümmel
Centaurii herba Tausendgüldenkraut
Chelidonii herba Schöllkraut
Cimicifugae rhizoma Traubensilberkerzenwurzelstock
Cinnamomi cortex Zimtrinde
Crataegi folium cum flore Weißdornblätter mit Blüten
Curcumae longae rhizoma Curcumawurzelstock
Cynarae folium Artischockenblätter
Echinaceae pallidae radix Echinacea-pallida-Wurzel
Echinaceae purpureae herba Purpursonnenhutkraut
Echinaceae purpureae radix Purpursonnenhutwurzel
Eleutherococci radix Eleutherococcus
Eucalypti aetheroleum Eukalyptusöl
Filipendulae ulmariae herba Mädesüß
Foeniculi fructus Fenchel
Foenugraeci semen Bockshornsamen
Frangulae cortex Faulbaumrinde
Gentianae radix Enzianwurzel
Ginkgo folium Ginkgoblätter
Ginseng radix Ginseng
Hamamelidis aqua Hamameliswasser
Hamamelidis cortex Hamamelisrinde
Hamamelidis folium Hamamelisblätter
Harpagophyti radix Teufelskrallenwurzel
Hederae helicis folium Efeublätter
Hippocastani semen Rosskastaniensamen
Humuli lupuli strobuli Hopfenzapfen
Hyperici herba Johanniskraut
Juniperi fructus Wacholderbeeren
Lichen islandicus Isländisch Moos
Lini semen Leinsamen
Liquiritiae radix Süßholzwurzel
Matricariae flos Kamillenblüten
Meliloti herba Steinkleekraut
Melissae folium Melissenblätter
Menthae piperitae aetheroleum Pfefferminzöl
Menthae piperitae folium Pfefferminzblätter
Myrrha Myrrhe
Myrtilli fructus Heidelbeeren
Ononidis radix Hauhechelwurzel
Orthosiphonis folium Orthosiphonblätter
Passiflorae herba Passionsblumenkraut
Piperis methystici rhizoma Kava-Kava-Wurzelstock
Plantaginis lanceolatae herba Spitzwegerichkraut
Plantaginis ovatae semen Indische Flohsamen
Plantaginis ovatae testa Indische Flohsamenschalen
Polygalae radix Senegawurzel
Primulae radix Primelwurzel
Psyllii semen Flohsamen
Rhamni purshianae cortex Amerikanische Faulbaumrinde
Rhei radix Rhabarberwurzel
Ribis nigri folium Schwarze Johannisbeerblätter
Rosmarini folium Rosmarinblätter
Rusci aculeati rhizoma Stechender Mäusedorn
Salicis cortex Weidenrinde
Salviae folium Salbeiblätter
Sennae folium Sennesblätter
Sennae acutifoliae fructus Sennesfrüchte (Alexandriner)
Sennae angustifoliae fructus Sennesfrüchte (Tinnevelly)
Serenoae repentis fructus Sägepalmenfrüchte
Solidaginis herba Goldrutenkraut
Tanaceti parthenii herba Fieberkraut
Taraxaci folium Löwenzahnblätter
Taraxaci radix Löwenzahnwurzel
Thymi herba Thymiankraut
Urticae folium Brennnesselblätter
Urticae radix Brennnesselwurzel
Uvae ursi folium Bärentraubenblätter
Valerianae radix Baldrianwurzel
Zingiberis rhizoma Ingwerwurzelstock
|
Zwar können die Monographien der ESCOP nicht ein Sachverständigengutachten oder eine Dokumentation der wissenschaftlichen Daten in einem Zulassungsantrag ersetzen, sie können aber als Basis für die Erstellung eines Dossiers dem Antragsteller einen guten Einblick in die Datenlage hinsichtlich Umfang und Qualität verschaffen.
Im wissenschaftlichen Komitee der ESCOP, das in zwei Unterkomitees an der Erstellung der Monographien arbeitet, sind Wissenschaftler aus ganz Europa vertreten (s. Kasten "Experten der ESCOP").
Experten der ESCOP (2008)
Mitglieder des ESCOP Scientific Committee
Dr. Anna Rita Bilia, Italien
Peter R. Bradley, Großbritannien
Dr. Jan G. Bruhn, Schweden
Dr. Jozef G. Corthout, Belgien
Dr. Frans M. van den Dungen, Niederlande
Dr. Marijke Frater-Schröder, Schweiz
Dr. Nicola Fuzzati, Italien
Dr. Lene Gudiksen, Dänemark
Didier Guédon, Frankreich
Dr. Stephen Hicks, Großbritannien
Dr. Ingrid Hook, Irland
Dr. Stephan F.A.J. Horsten, Niederlande
Prof. Dr. Liselotte Krenn, Österreich
Frédérique Lafforgue, Frankreich
Dr. Norbert Linnenbrink, Schweiz
Dr. Georg Seidel, Deutschland
Prof. Dr. Ekrem Sezik, Türkei
Dr. Barbara Steinhoff, Deutschland
Dr. Sonja Sturm, Österreich
Board of Supervising Editors der ESCOP
Prof. Dr. R. Anton, Straßburg (F)
Prof. Dr. D. Corrigan, Dublin, (IRL)
Prof. Dr. P. Delaveau, Paris (F)
Prof. Dr. G. Franz, Regensburg (D)
Prof. Dr. H. van Dijk, De Bilt (NL)
Prof. Dr. C. Harvala, Athen (GR)
Prof. Dr. F. H. Kemper, Münster (D)
Prof. Dr. K. Kraft, Rostock (D)
Prof. Dr. W. Kubelka, Wien (A)
Prof. Dr. Dr. D. Loew, Wiesbaden (D)
Prof. Dr. E. Ollivier, Marseille (F)
Prof. Dr. R. Saller, Zürich (CH)
Prof. Dr. H. Schilcher, München (D)
Prof. Dr. T. Simmet, Ulm (D)
Prof. Dr. O. Sticher, Zürich (CH)
Prof. Dr. F. F. Vincieri, Florenz (I)
Prof. Dr. A.J. Vlietinck, Antwerpen (B)
Prof. Dr. J.H. Zwaving, Groningen (NL)
|
Vorsitzende des Komitees sind Dr. Barbara Steinhoff und Dr. Stephan Horsten; Schriftführerinnen sind Dr. Marijke Frater und Prof. Dr. Liselotte Krenn.
Nach Fertigstellung einer Monographie im wissenschaftlichen Komitee wird diese dem Board of Supervising Editors zugeleitet, einem internationalen Hochschullehrer-Gremium, das aus Experten der Pharmakognosie, Pharmakologie, klinischen Anwendung etc. besteht.
Nach Eingang der zumeist detaillierten und kritischen Kommentare der Supervising Editors wird die Monographie nochmals im wissenschaftlichen Komitee diskutiert, entsprechend modifiziert und endgültig verabschiedet.
Praktische Umsetzung der Richtlinien wird spannend
Das EG-Recht unterscheidet zwei Kategorien von Phytopharmaka, die für das Zulassungsverfahren relevant sind: Im Bereich des "well-established medicinal use" basiert die Zulassung auf bibliographischen Unterlagen, im Bereich des "traditional use" auf der langjährigen Anwendung. Ob und inwieweit pharmazeutische Unternehmen diese Verfahren gewinnbringend nutzen, hängt nicht zuletzt von der Vorgehensweise der Behörden in den einzelnen EU-Mitgliedstaaten ab, beispielsweise was die Interpretation der gesetzlichen Anforderungen an die vorzulegenden Unterlagen betrifft. Aber auch bei der Frage, ob für eine beanspruchte Indikation die beantragte Einstufung des Arzneimittels adäquat ist, bestehen große Unterschiede. Bei allen begrüßenswerten Harmonisierungsbestrebungen ist es daher äußerst wichtig, dass ein solcher Prozess, an dem jeweils bis zu 27 Mitgliedstaaten beteiligt sein können, nicht zu einem Minimum an zugelassenen Anwendungsgebieten und einem Maximum an Risikoangaben führt.
Literatur bei der Verfasserin
Autorin
Dr. Barbara Steinhoff studierte Pharmazie an der Universität Bonn und promovierte dort 1987 am Institut für Pharmazeutische Biologie über Phenole in Braunalgen. Nach dreijähriger Tätigkeit in der Qualitätskontrolle, der Arzneimittelzulassung und der Arzneimittelsicherheit bei pharmazeutischen Unternehmen in Hannover und Münster ist sie seit 1990 als wissenschaftliche Mitarbeiterin für den Bereich Phytopharmaka beim Bundesverband der Arzneimittel-Hersteller e.V. (BAH) beschäftigt und arbeitet seitdem im wissenschaftlichen Komitee der ESCOP, seit 2002 als Co-chairperson, mit.
Dr. Barbara Steinhoff
Bundesverband der Arzneimittel-Hersteller
Ubierstr. 71–73, 53173 Bonn
E-Mail: steinhoff@bah-bonn.de


















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.