
- DAZ.online
- DAZ / AZ
- DAZ 30/2008
- Methylnaltrexon blockiert...
Arzneimittel und Therapie
Methylnaltrexon blockiert Darmrezeptoren
Viele Patienten, die ein Opioid zur Schmerzlinderung erhalten, fürchten die Nebenwirkung Obstipation genauso wie die Schmerzen selbst, was eine Gefahr für die Compliance bedeutet und damit den Behandlungserfolg gefährden kann. Die zur Milderung dieser unerwünschten Wirkung prophylaktisch verabreichten Laxanzien verbessern Untersuchungen zufolge nur bei jedem zweiten Patienten die Beschwerden.
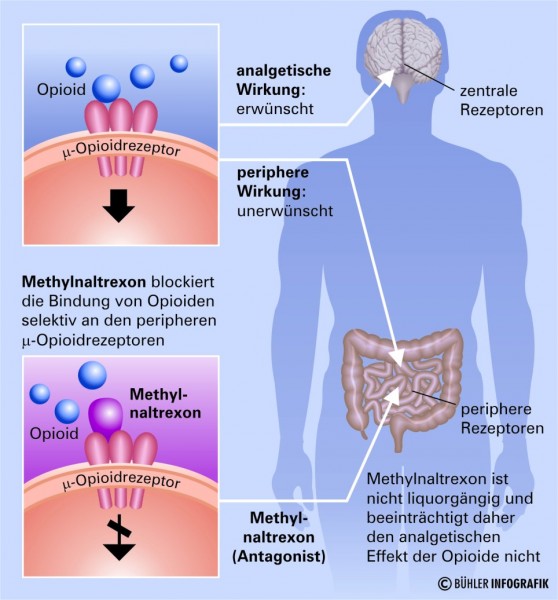
Angriff an peripheren Rezeptoren
Opioidrezeptoren (μ-, κ- und δ-Rezeptoren) befinden sich nicht nur im ZNS, sondern im gesamten Körper. Während die Bindung von starken Opioiden wie Morphin, Oxycodon, Hydromorphon oder Fentanyl an die Rezeptoren im ZNS eine Schmerzreduktion bewirkt, führt sie in der Peripherie zu unerwünschten Wirkungen, beispielsweise im Darm zur Obstipation. Bei der Bindung von Opioiden an periphere µ-Rezeptoren wird die Freisetzung von Acetylcholin aus dem Plexus myentericus gehemmt, was eine Erschlaffung der Längsmuskulatur des Darms zur Folge hat. Dies führt wiederum zur Abnahme der propulsiven Motorik und damit zur Verlängerung der oro-zoekalen Transitzeit sowie zum Wasserentzug und damit zur Eindickung der Fäzes, was schließlich in eine Obstipation mündet. Die Folgen sind unter anderem Schmerzen beim Stuhlgang, Völlegefühl und Bauchschmerzen bis hin zu Koliken. Auch Komplikationen wie Peritonitis oder eine Coecumperforation können auftreten.
Kausale Therapie jetzt möglich
Der periphere µ-Opioid-Rezeptorantagonist Methylnaltrexon ist der erste in Europa zugelassene Vertreter eines neuen Wirkprinzips. Er hemmt die Bindung der Opioide an ihre Rezeptoren kompetitiv. Da er in der Darreichungsform als quartäres Amin (Methylnaltrexoniumbromid) vorliegt, besitzt er eine geringe Lipidlöslichkeit. Dadurch kann er die Blut-Hirn-Schranke nicht überwinden, und der analgetische Effekt der Opioide im ZNS bleibt bestehen.
Obstipation rechtzeitig erkennenBei schwerkranken pflegebedürftigen Patienten wird eine Obstipation häufig zu spät erkannt. Mögliche Ursachen dafür sind beispielsweise:
|
Einzeldosis alle zwei Tage empfohlen
Verabreicht wird Methylnaltrexon subkutan, das übliche Dosierungsschema ist eine Einzeldosis jeden zweiten Tag. Je nach klinischer Notwendigkeit können auch längere Dosierungsintervalle gewählt werden. Eine Verkürzung des zeitlichen Abstandes auf 24 Stunden ist nur dann möglich, wenn die Patienten auf die Dosis des vorangegangenen Tages nicht angesprochen haben, das heißt, keine Darmtätigkeit zu verzeichnen war.
Die empfohlenen Dosen liegen bei 8 mg für Patienten mit einem Körpergewicht von 38 bis 61 kg und 12 mg für Patienten mit einem Körpergewicht von 62 bis 114 kg.
Schneller Wirkungseintritt
Die Wirksamkeit und Sicherheit von Relistor® wurde in zwei doppelblinden randomisierten Phase-III-Studien überprüft. Eingeschlossen waren Patienten mit fortgeschrittener Erkrankung und konstanter Opioid-Behandlung, die in den vorangegangenen 48 Stunden keinen oder in der vorangegangenen Woche weniger als dreimal Stuhlgang hatten. In der ersten Studie (Dosisfindungsstudie mit 154 Patienten) kam es bei 62 Prozent der Patienten bei einer Dosis von 0,15 mg/kg Methylnaltrexon innerhalb von vier Stunden zum Stuhlgang, im Placebo-Arm dagegen nur bei 13 Prozent.
In der zweiten Studie (Zulassungsstudie mit 134 Patienten) mit einem Beobachtungszeitraum von zwei Wochen hatten 79 Prozent der Patienten nach mindestens einer der insgesamt sieben Gaben von Methylnaltrexon innerhalb von vier Stunden Stuhlgang. Bei der Hälfte der Patienten, die innerhalb von vier Stunden auf den Wirkstoff ansprachen, lag die mittlere Zeit bis zum Stuhlgang sogar bei nur 30 Minuten, was für einen schnellen Wirkungseintritt spricht. Im Anschluss an die doppelblinde Phase dieser Studie konnten sich die Patienten an einer offenen Behandlungsphase über drei Monate beteiligen, wobei sich eine lang anhaltende Wirksamkeit der Substanz zeigte, und zwar sowohl bei den Patienten, die bereits über zwei Wochen das Verum erhalten hatten, als auch bei den vormaligen Placebo-Patienten.
Steckbrief: MethylnaltrexonHandelsname: Relistor Hersteller: Wyeth Pharma GmbH, Münster Einführungsdatum: 15. Juli 2008 Zusammensetzung: Jede Durchstechflasche mit 0,6 ml enthält 12 mg Methylnaltrexoniumbromid. 1ml der Lösung enthält 20 mg Methylnaltrexoniumbromid. Sonstige Bestandteile: 1 Durchstechflasche mit 0,6 ml Injektionslösung enthält 12 mg Natriumchlorid; außerdem Natriumcalciumedetat, Glycinhydrochlorid, Wasser für Injektionszwecke, Salzsäure (zur pH-Einstellung), Natriumhydroxid (zur pH-Einstellung). Packungsgrößen, Preise und PZN: 1 Durchstechflasche, 55,11 Euro, PZN 6717288; 7 Durchstechflaschen, 327,95 Euro, PZN 6717302. Stoffklasse: Opioidantagonist. ATC-Code: bislang keine Zuordnung. Indikation: Zur Behandlung von opioidinduzierter Obstipation bei Patienten in fortgeschrittenen Krankheitsstadien, die eine palliative Behandlung erhalten, wenn das Ansprechen auf eine Therapie mit den üblichen Laxantia unzureichend ist. Dosierung: 8 mg (0,4 ml Relistor®) für Patienten mit einem Gewicht von 38 - 61 kg oder 12 mg (0,6 ml Relistor®) für Patienten mit einem Gewicht von 62 – 114 kg, ansonsten 0,15 mg/kg KG, als Einzeldosis jeden zweiten Tag. Die Dosen können auch, je nach klinischer Notwendigkeit, in längeren Intervallen gegeben werden. Bei schweren Nierenfunktionstörungen sollte die Dosis reduziert werden, bei Leberfunktionsstörungen ist keine Anpassung erforderlich. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile. Anwendung bei Patienten mit bekanntem oder vermutetem mechanischem gastrointestinalem Verschluss oder akutem chirurgischem Abdomen. Nebenwirkungen: Sehr häufig: abdominaler Schmerz, Übelkeit, Flatulenz, Durchfall. Häufig: Schwindel. allgemeine Beschwerden an der Injektionsstelle. Wechselwirkungen: Methylnaltrexon wird minimal über CYP-Isoenzyme metabolisiert und beeinflusst die Pharmakokinetik von anderen Arzneimitteln, die über diese Enzyme metabolisiert werden, nicht. Warnhinweise und Vorsichtsmaßnahmen: Methylnaltrexon sollte nicht zur Behandlung von Patienten verwendet werden, deren Obstipation nicht durch die Anwendung von Opioiden bedingt ist. Bei schwerer oder anhaltender Diarrhö während der Therapie sollten die Patienten die Therapie mit Methylnaltrexon nicht fortsetzen. Methylnaltrexon sollte nur bei Patienten, die eine palliative Behandlung erhalten, eingesetzt werden, zusätzlich zur üblichen Behandlung mit Laxantia. Methylnaltrexon wird bei Patienten mit schwerer Leberfunktionsstörung oder dialysepflichtiger terminaler Nierenfunktionsstörung nicht empfohlen. Bei Patienten mit Kolostomie, Peritonealkatheter, aktiver divertikulärer Erkrankung oder Koprostase sollte es nur mit Vorsicht angewendet werden. |
Gute Verträglichkeit in klinischen Studien
Die Verträglichkeit von Methylnaltrexon war in den beiden Studien gut. Flüchtige Bauchkrämpfe und Flatulenz, die von den Patienten jeweils als mild oder moderat beschrieben wurden, gehörten zu den häufigsten Beschwerden. Die übrigen Nebenwirkungen lagen auf Placeboniveau, die der Grade 3 und 4 standen in keinem Zusammenhang mit Methylnaltrexon.
Der analgetische Effekt der Opioide blieb bestehen; in keiner der beiden Studien zeigten sich signifikante Änderungen bei der analgetischen Wirkung. Entzugssymptome oder klinisch relevante Hautirritationen an der Injektionsstelle traten ebenfalls nicht auf.
Aus Sicht von Experten besitzt Methylnaltrexon auch ein Potenzial für weitere Indikationsgebiete, denn auch Nebenwirkungen wie Harnretention, Juckreiz, Übelkeit und Erbrechen werden durch Bindung der Opioide an periphere Rezeptoren vermittelt. Diese könnten durch eine Behandlung mit Methylnaltrexon gemildert werden, dazu sind jedoch noch entsprechende Studien notwendig. Für die Indikation opioidinduzierte Obstipation erhielt Methylnaltrexon im April 2008 die Zulassung durch die FDA und im Juli 2008 durch die europäische Zulassungsbehörde EMEA.
Quellen
Dr. Andreas Kuhrau, Münster, PD Dr. Peter Löschmann, Münster, Dr. Reinhard Sittl, Erlangen, Prof. Dr. Peter Conzen, München, Prof. Dr. Peter Osterbrink, Salzburg: "Relistor® – erste kausale Therapie der Opioid-induzierten Obstipation erhält EMEA-Zulassung", Launch-Pressekonferenz am 3. Juli 2008 in Berlin, veranstaltet von der Wyeth Pharma GmbH, Münster.
Thomas J et al.: Methylnaltrexone for opioid-induced constipation in advanced illness. N Engl J Med 2008, 358:2332-43.
Apothekerin Dr. Claudia Bruhn


















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.