
- DAZ.online
- News
- Spektrum
- Gelockerte Regeln für ...
Indien
Gelockerte Regeln für die klinische Forschung
Remagen - 08.08.2016, 10:00 Uhr

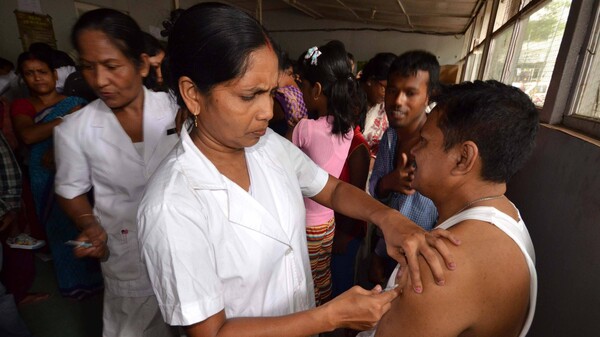
Klinische Prüfungen in Indien sollen in Zukunft weniger strengen Regeln unterliegen. (Foto: eyegelb / Fotolia)
Die indische Central Drugs Standard Control Organization (CDSCO) hat ihre Regeln für klinische Prüfungen aus dem Jahr 2014 gelockert. Außerdem revidiert der indische Rat für die klinische Forschung (ICMR) seine Ethik-Richtlinien.
Die oberste Arzneimittelaufsicht in Indien (CDSCO) hat zwei Beschränkungen für die Durchführung klinischer Prüfungen auf dem Subkontinent aufgehoben. Zum einen geht es um die Größe der klinischen Einrichtungen, in denen Studien erlaubt sind. Bisher galt dafür die Regel, dass eine solche Einrichtung nicht weniger als fünfzig Betten haben durfte. Diese Mindestzahl wird nun abgeschafft. Außerdem soll eine Ethikkommission darüber entscheiden, ob diese die Voraussetzungen für die Durchführung der jeweiligen Prüfung besitzt oder nicht, und zwar unabhängig von der Anzahl der Betten, über die sie verfügt. Allerdings sollte sie eine Notfallversorgung bereitstellen können und sämtliche Einrichtungen besitzen, die für die jeweilige Studie notwendig sind.
Wie viele Prüfungen gleichzeitig?
Die zweite Liberalisierung betrifft die Anzahl der Prüfungen, die ein klinischer Prüfer gleichzeitig durchführen darf. Auch diese Beschränkung soll nicht mehr gelten und einer Ethikkommission die Entscheidung übertragen werden, wie viele Prüfungen ein klinischer Prüfer gleichzeitig leiten darf. Dabei soll sie das Risiko und die Komplexität der Studien berücksichtigen.
Nach den Rundschreiben der CDSCO sind die Erleichterungen das Ergebnis von Experten-Beratungen im August und im Oktober 2015 über Bedenken der Stakeholder hinsichtlich der Zukunft der klinischen Forschung in Indien.
Entwurf neuer Ethik-Leitlinien
Etwa zeitgleich hat der indische Rat für die klinische Forschung (Indian Council of Medical Research, ICMR) den Entwurf "Nationaler Ethik-Leitlinien für die biomedizinische und die Gesundheitsforschung am Menschen 2016“ bekannt gemacht. Damit werden die Ethik-Leitlinien des ICMR für die biomedizinische Forschung am Menschen von 2006 revidiert.
Die neuen Leitlinien sollen für alle biomedizinischen Untersuchungen am Menschen gelten, inklusive der dabei anfallenden biologischen Materialien und Daten. Auch auf die Sozial-, und die Verhaltensforschung sollen sie in Zukunft angewendet werden. Die Revision berücksichtige das verantwortliche Handeln in der Forschung und neue Technologien, heißt es in der Präambel. Außerdem seien einige spezielle Aspekte wie der Einwilligungsprozess, biologische Materialien und Datensätze, die Vulnerabilität von Studienteilnehmern, die internationale Zusammenarbeit sowie die Forschung in humanitären Notfällen und Katastrophen erweitert worden.
Spezielles sozio-kulturelles Milieu
Die
Neufassung beinhaltet wichtige Orientierungspunkte aus internationalen
Richtlinien, die aber an das soziokulturelle Milieu Indiens angepasst wurden. Dies
wird damit begründet, dass „das soziokulturelle Ethos in Indien und seine
unterschiedlichen Standards der Gesundheitsversorgung einzigartige
Herausforderungen an die Anwendung der universellen ethischen Prinzipien zu
Biomedizin und Gesundheitsforschung stellen“. Es wird betont, dass die
Forschung so durchgeführt werden soll, dass kein Versuchsteilnehmer „als Mittel
zum Wohle anderer benutzt wird“. Außerdem sollten Menschen, die an
medizinischen Studien oder wissenschaftlichen Versuchen teilnehmen, im Einklang
mit ihrer Würde und ihrem Wohlergehen behandelt werden. Da jede Forschung
inhärente Risiken und die Wahrscheinlichkeiten von Schaden für die Teilnehmer oder
die Gemeinschaft berge, soll der Schutz der Teilnehmer in die Gestaltung des
Studiendesigns mit „eingebaut“ werden.
Interessierte Stakeholder können bis zum 15. September 2016 zu dem Entwurf Stellung
nehmen.


























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.