
- DAZ.online
- DAZ / AZ
- DAZ 16/2017
- Gestörter Knochenumbau
Pharmakologie
Gestörter Knochenumbau
Wie Biologicals die Osteoporose-Therapie verbessern können
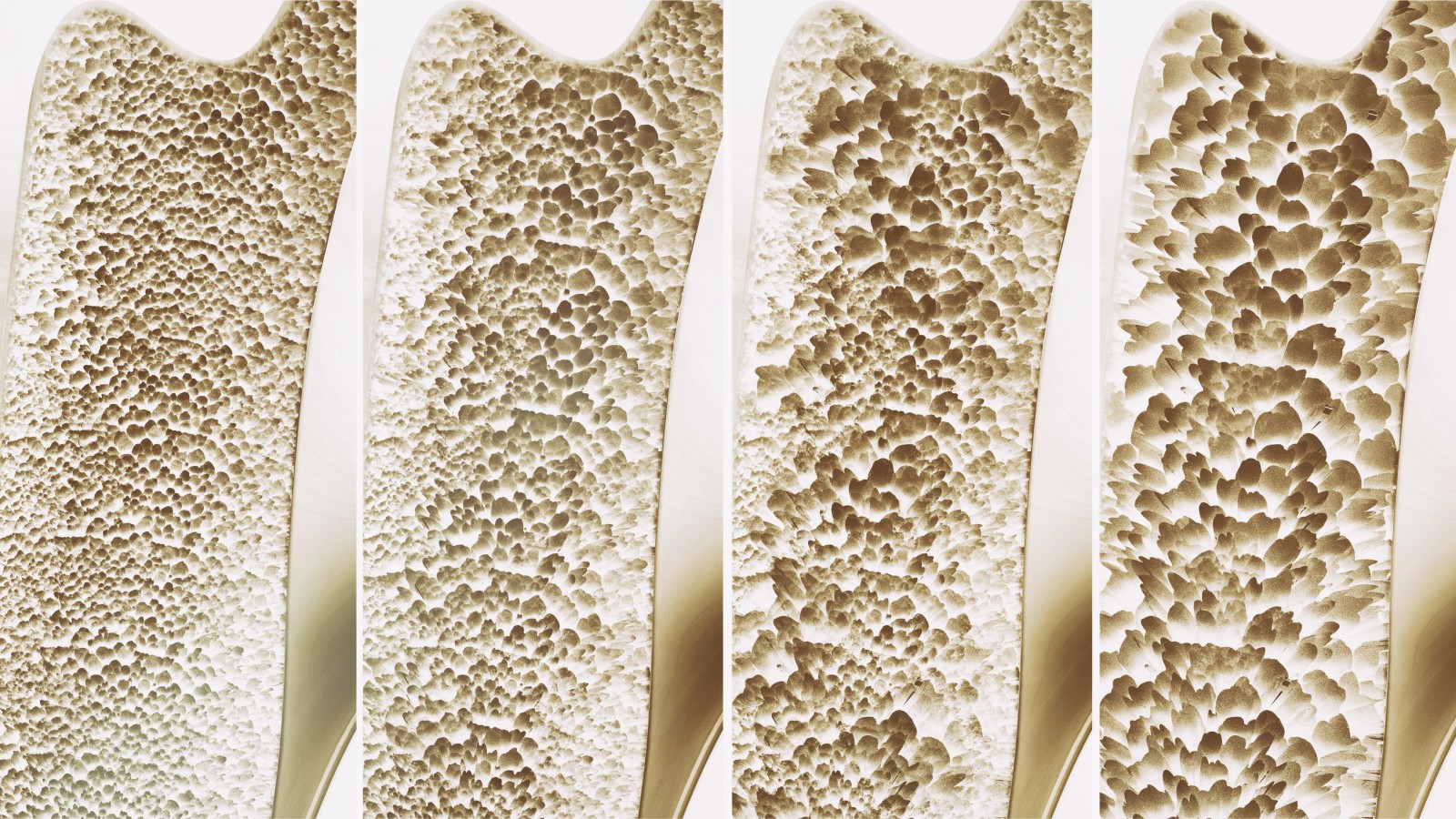
Ein Gerüst aus möglichst belastbaren Knochen, die trotzdem eine gewisse Flexibilität aufweisen, bildet die Grundvoraussetzung für Stabilität und Beweglichkeit unseres Organismus. Auch nach Abschluss des Längenwachstums sind Knochen keineswegs starre Gebilde, sondern sehr komplexen regulatorischen Prozessen unterworfen. Knochen wird im Körper permanent an bestimmten Stellen abgebaut, um durch neue Substanz ersetzt oder an veränderte Belastungen angepasst zu werden. Neubildung von Knochensubstanz, die im Falle der Reparatur einer Fraktur selbstverständlich erscheint, ist im Zusammenspiel mit einem geregelten Knochenabbau also Bestandteil des normalen physiologischen Geschehens. Heute kennen wir bereits viele verschiedene Einflussfaktoren, über welche diese Umbauprozesse gesteuert werden (Abb. 1). Dennoch sind wir weit davon entfernt, mit Arzneistoffen das physiologische System perfekt imitieren zu können. Bei Patienten mit Osteoporose ist die Balance zwischen Auf- und Abbau zugunsten des Knochenabbaus verschoben. Die Dichte und Masse des Knochens nehmen stetig ab. Selbst an denjenigen Stellen, an denen der Körper diesem Geschehen erfolgreich entgegen wirkt, entsteht oftmals ein Knochengewebe mit veränderten strukturellen Eigenschaften und daraus resultierender verringerter Belastbarkeit. Klinisch sichtbar wird die abnehmende Knochenmasse in einer reduzierten Knochenmineraldichte. Dies ist mittels Doppelröntgen-Absorptiometrie (DXA-Messung) erfassbar. Abweichungen zum altersgleichen gesunden Kollektiv werden als sogenannter Z-Wert, Veränderungen bezogen auf junge gesunde Menschen als T-Wert ausgedrückt. Letzterer wird zur Diagnostik des Osteoporose-Grades herangezogen.
Bedeutung von Calcium, Phosphat und Vitamin D3
Den anorganischen Bestandteil des Knochens bildet ein stabiles Gerüst aus Hydroxylapatit. Um dieses aufbauen zu können, werden aus der Knochenmatrix so lange aus organischen Verbindungen Phosphat-Ionen freigesetzt, bis das Löslichkeitsprodukt für Calciumphosphat überschritten ist. Die Aufnahme und Bereitstellung von Calcium und Phosphat unterliegen einer hormonellen Regulation, bei der Calcitonin, Parathormon und das aus seiner Vorstufe Colecalciferol (Vitamin D3) gebildete Calcitriol zusammenarbeiten. Calcitonin wirkt osteanabol, das heißt, es fördert die Einlagerung von Calcium- und Phosphat-Ionen in das Knochengewebe. Parathormon hat den gegenteiligen Effekt. Es kann bei Bedarf durch erhöhte Calcium-Freisetzung aus dem Knochen die Plasmacalcium-Konzentration schnell anheben. In Darm und Nieren steigert Parathormon unterstützend dazu die Calcium-Resorption, Calcitonin hingegen sorgt für eine vermehrte renale Elimination von Calciumphosphat. Für die Resorptionsprozesse in Niere und Darm stellt Calcitriol einen wichtigen Co-Faktor dar. Ein Anstieg der Parathormon-Konzentration im Blut führt zur vermehrten Bildung der renalen 1α-Hydroxylase, welche das inaktive Calcidiol (25-Hydroxy-Vitamin D3) in aktives Calcitriol überführt. Calcitriol fördert unter anderem die Synthese Calcium-bindender Proteine, was eine erhöhte intestinale Calcium-Resorption zur Folge hat.
Osteoklasten und Osteoblasten
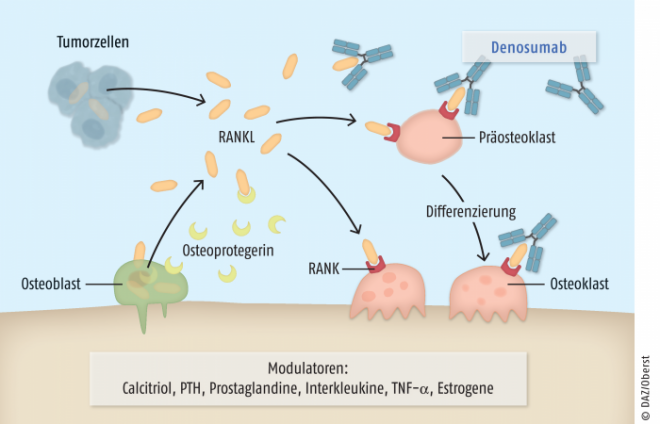
Der Umbau von Knochen wird durch knochenaufbauende Osteoblasten und knochenabbauende Osteoklasten reguliert. Calcitriol aktiviert Osteoblasten und hemmt Osteoklasten, was den Knochenumbau fördert. Parathormon wirkt auch hier als Gegenspieler, da zwar beide Zelltypen stimuliert werden, aber bei einem lang anhaltenden Anstieg der Hormonkonzentration die Tätigkeit der Osteoklasten und damit der Knochenabbau überwiegen. Auf die Zellen des Knochengewebes wirkt eine Vielzahl weiterer Mediatoren ein. Als therapeutischer Angriffspunkt wichtig ist das Protein RANKL (Receptor Activator of Nuclear factor κB Ligand), ein Mitglied der Familie der Tumornekrosefaktoren (TNF-Familie). Es wird von Osteoblasten und im pathologischen Kontext auch von Tumorzellen sezerniert, fördert die Differenzierung von Präosteoklasten zu Osteoklasten sowie deren Aktivität. Körpereigen wird RANKL durch das ebenfalls von Osteoblasten freigesetzte lösliche Protein Osteoprotegerin gebunden und dadurch inaktiviert. So entsteht eine Balance zwischen Knochenauf- und -abbau. Estrogene hemmen viele der knochenresorptiv wirkenden Faktoren, wie TNF-α und Interleukin-1 und fördern zudem die Bildung von Osteoprotegerin oder dem in Osteoklasten Apoptose auslösenden TGF-β. Dies erklärt, weshalb ein Abfall des Estrogen-Spiegels postmenopausal zu Osteoporose führen kann.
Knochenabbau im Übermaß: Osteoporose
Die Verminderung der Knochenmasse ist innerhalb gewisser Grenzen ein normaler Prozess des Alterns. Diese sogenannte „senile Osteoporose“ tritt bei Männern und Frauen auf und hat in der Regel eine langsame Progredienz. Die Ursachen sind vielfältig und schließen Veränderungen im Hormonhaushalt, in der Bewegung oder auch bei der täglichen Calcium-Zufuhr mit ein. Die häufigste primäre Krankheitsform stellt sicherlich die postmenopausale Osteoporose der Frau dar, bei welcher die Abnahme der endogenen Estrogen-Produktion treibende Kraft des Krankheitsgeschehens ist. Im Kindesalter kommt Osteoporose als eigenständige Erkrankung, die „idiopathische juvenile Osteoporose“, sehr selten vor. Die Ursachen für dieses Krankheitsbild sind weitestgehend unbekannt. Neben den zuvor genannten Formen gibt es auch eine große Zahl von Patienten, bei denen die Osteoporose Folge einer anderen Grunderkrankung ist. Zu diesen sekundären Formen der Osteoporose zählen die Abnahme der Knochenmasse bedingt durch Hyperthyreose, gesteigerte Produktion von Parathormon, erhöhte Glucocorticoid-Konzentrationen (endogen als Morbus Cushing oder in Folge einer länger andauernden Therapie mit glucocorticoidhaltigen Arzneimitteln) oder auch durch längere Phasen der Immobilität.
Biologicals zur Behandlung der Osteoporose
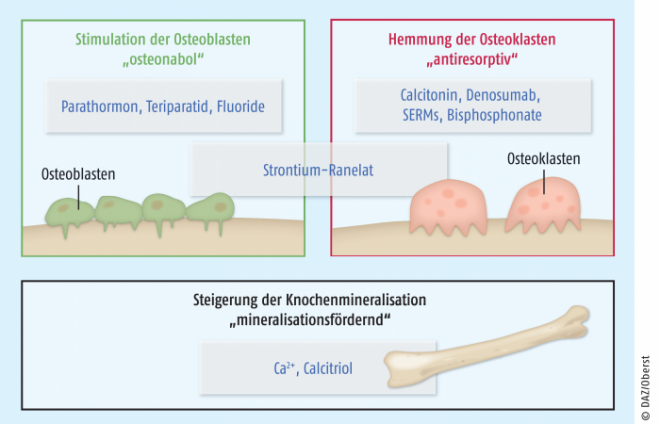
Die Therapie der Osteoporose basiert auf verschiedenen Ansätzen (Abb. 1). Bisphosphonate und selektive Estrogen-Rezeptormodulatoren (SERMs) steigern die Knochendichte vor allem über eine Hemmung des Knochenabbaus, d. h. sie wirken antiresorptiv. Strontium, das therapeutisch als Salz der Ranelinsäure gegeben wird, ist zudem noch osteoanabol, also knochenaufbauend. Die Therapie mittels Vitamin D3/Calcium hat demgegenüber in erster Linie mineralisationsfördernde Effekte. Therapeutische Proteine haben seit mehreren Jahren ebenfalls Eingang in die medikamentöse Osteoporose-Therapie gefunden. Biologicals werden derzeit in Form des Parathormon-Fragments Teriparatid und des gegen RANKL gerichteten monoklonalen Antikörpers Denosumab genutzt (Abb. 2). In bestimmten Fällen, in denen die Knochenstoffwechselstörung nicht alleine durch eine Osteoporose bedingt ist, kann auch rekombinant hergestelltes Calcitonin vom Lachs Verwendung finden. Aufgrund des ungünstigen Nutzen-Risiko-Verhältnisses (kanzerogenes Potenzial bei Langzeitanwendung) spielt Calcitonin heute für die Osteoporose-Therapie kaum noch eine Rolle und wird hier nicht weiter besprochen.
Das Parathormon-Fragment Teriparatid
Wie zuvor beschrieben wurde, beeinflusst Parathormon (PTH) knochenauf- und -abbauende Prozesse. Eine kontinuierlich erhöhte Parathormon-Konzentration führt zu einem Verlust an Knochenmasse, bei einer einmal täglichen Gabe überwiegt jedoch sowohl auf trabekuläres als auch auf kortikales Knochengewebe der osteoanabole Einfluss. Dies macht man sich zunutze, um mittelfristig eine Zunahme der Knochendichte zu erreichen. Rekombinantes Parathormon (rPTH, Preotact®) ist identisch mit dem 84 Aminosäuren langen, endogen gebildeten Peptidhormon und war von 2008 bis 2013 auf dem deutschen Markt verfügbar. Seit 2003 ist mit Teriparatid (Forsteo®) eine verkürzte, aber voll wirksame Form des Parathormons im Handel. Teriparatid wird gentechnisch in Escherichia coli produziert und besteht aus den ersten 34 N-terminalen Aminosäuren der humanen Sequenz. Es bindet wie endogenes Parathormon an PTH-1-Rezeptoren auf Osteoblasten. Bei Aktivierung dieser Rezeptoren werden die Osteoblasten-Differenzierung und die Sekretion von wachstumsfördernden Mediatoren, wie z. B. den Insulin-ähnlichen Wachstumsfaktoren IGF-1 und -2, gesteigert. Erst wenn die Hormonkonzentration nicht mehr nur pulsatil ansteigt, sondern dauerhaft erhöht bleibt, werden auch an der Membran von knochenabbauenden Osteoklasten Parathormon-Rezeptoren ausgebildet. Hieraus kann als Nettoeffekt eine gesteigerte Knochenresorption resultieren. Um dies zu vermeiden, wird Teriparatid einmal täglich subkutan injiziert. Die Plasmahalbwertszeit ist bei dieser Applikationsart im Vergleich zur intravenösen Gabe von fünf Minuten auf ca. eine Stunde verlängert, da die Resorption deutlich langsamer verläuft als der Arzneistoffabbau. Die maximale Plasmakonzentration ist nach 30 Minuten erreicht. Danach fällt sie relativ schnell wieder ab, so dass ein pulsatiler Verlauf resultiert. Depotformen oder eine häufigere Gabe sind nicht sinnvoll, da dies dem osteoanabolen Effekt aus den zuvor genannten Gründen entgegenwirken würde. Teriparatid ist bei Männern und Frauen mit erhöhtem Frakturrisiko infolge einer primären Osteoporose oder einer systemischen Langzeittherapie mit Glucocorticoiden indiziert. Nicht eingesetzt werden darf das Hormonfragment bei Knochenstoffwechselerkrankungen, denen ein Morbus Paget, ein Hyperparathyreoidismus oder eine metastasierende Krebserkrankung zugrunde liegen. Da Teriparatid die Calcium-Resorption erhöht und gleichzeitig dessen renale Elimination verringert, kann es zum transienten Anstieg der Plasmacalcium-Konzentration kommen. Zu den häufig auftretenden unerwünschten Wirkungen gehören Schwindel, Kopf-, Glieder- und Thoraxschmerzen, Palpitationen und orthostatische Dysregulation.
Ende 2016 wurde für das erste Teriparatid-Biosimilar (Movymia®, Stada) ein positives Votum des Ausschusses für Humanarzneimittel der europäischen Zulassungsbehörde erteilt. Mit einer Markteinführung wird innerhalb dieses Jahres gerechnet.
Therapie mit Teriparatid
Der vorgefüllte Injektor von Forsteo® enthält insgesamt 600 µg Teriparatid (gelöst in 2,4 ml Injektionslösung), davon werden 20 µg pro Tag in einem Volumen von 80 µl subkutan in den Oberschenkel oder Bauchbereich gespritzt. Wegen einer im Tierexperiment erhöhten Inzidenz für Osteosarkome ist die Anwendung zeitlich auf maximal 24 Monate limitiert und darf nicht wiederholt werden. Da Teriparatid bei Kaninchen reproduktionstoxisch ist, gelten Schwangerschaft und Stillzeit als Kontraindikationen. Die Lösung ist nach Anbruch 28 Tage bei 2 bis 8 °C haltbar.
Der RANKL-Antikörper Denosumab
Die Aktivität der Osteoklasten ist abhängig von verschiedenen zirkulierenden Proteinen. Nach der Entdeckung des RANK-Rezeptors und dessen endogenen Liganden RANKL konzentrierte sich die Forschung zunächst auf die Entwicklung von therapeutisch einsetzbaren Abwandlungen des körpereigenen, von Osteoblasten sezernierten Glycoproteins Osteoprotegerin (Abb. 2). Daraus ging letztendlich der humane IgG2-Antikörper Denosumab (Prolia®, Xgeva®) hervor, welcher mit hoher Selektivität sowohl die lösliche als auch die bereits an den Rezeptor gebundene Form von RANKL bindet und inaktiviert. Damit imitiert Denosumab eine wichtige Funktion von Osteoprotegerin und verhindert so einen übermäßigen Knochenabbau. Im Unterschied zu Osteoprotegerin hat das Biological jedoch keine Affinität zu anderen Mitgliedern der TNF-Familie, wie z. B. TNF-α oder TRAIL. Anders als Bisphosphonate akkumuliert der monoklonale Antikörper auch bei mehrfacher Gabe nicht im Knochengewebe.
Denosumab ist zugelassen zur Therapie der postmenopausalen Osteoporose der Frau und bei Männern, die unter einem erhöhten Frakturrisiko leiden. In höherer Dosierung (siehe Kasten) ist der Antikörper auch präventiv zur Vermeidung von Komplikationen durch Knochenmetastasen bei bestehenden soliden Tumoren (jedoch nicht bei multiplem Myelom) indiziert sowie zur Behandlung von inoperablen Riesenzelltumoren des Knochens bei Erwachsenen und Jugendlichen mit ausgereiftem Knochenskelett. Eine weitere geplante europaweite Zulassung von Denosumab zur Therapie der Bisphosphonat-resistenten Hyperkalzämie bei Krebspatienten wurde seitens der Herstellerfirma Amgen im Januar 2017 zurückgenommen. Grund hierfür war, dass von der EMA noch weitere Studiendaten zur Wirksamkeit bei dieser Patientengruppe gefordert wurden.
Therapie mit Denosumab
In einer Konzentration von 60 mg (Fertigspritze, Prolia®) wird Denosumab alle sechs Monate zur Behandlung der postmenopausalen Osteoporose, der Osteoporose beim Mann und der verringerten Knochendichte infolge einer hormonablativen Therapie bei Patienten mit Prostata-Karzinom eingesetzt. 120 mg Denosumab (Durchstechflasche, Xgeva®) werden in vierwöchigem Intervall zur Prävention skelettbezogener Komplikationen (Frakturen) bei Knochenmetastasen aufgrund solider Tumore gegeben. Die Applikation ist subkutan am Oberschenkel, in der Bauchregion oder am Oberarm möglich. Wie bei jeder antiresorptiven Therapie besteht bei Gabe von Denosumab dosisabhängig das Risiko, einen Calcium-Mangel zu entwickeln. Dieser kann durch Tetanie, Parästhesien oder QT-Zeit-Verlängerung klinisch sichtbar werden. Mit Ausnahme von Patienten mit bereits bestehender Hyperkalzämie ist daher immer eine Kombination mit Vitamin D3 / Calcium zu empfehlen. Eine bestehende Hypokalzämie muss durch oben genannte Maßnahme vor Therapiebeginn ausgeglichen werden. Vor jeder Gabe von Denosumab soll zudem die Plasmacalcium-Konzentration bestimmt werden. Nierenfunktionsstörungen erhöhen mit steigendem Grad der Beeinträchtigung das Risiko für eine Hypokalzämie. Als Kompensationsversuch kann es zudem zu einem sekundären Hyperparathyreoidismus kommen.
Alte Probleme: Kieferosteonekrose und ...
Auch unter einer Therapie mit Denosumab treten, wie es bereits für Bisphosphonate beschrieben wurde, Kieferosteonekrosen und atypische Femur-Frakturen auf. Ursächlich für die Entwicklung einer Kieferosteonekrose ist das Absterben von Knochengewebe infolge eines Gefäßverschlusses. Solche unerwünschten Zwischenfälle wurden vor allem bei Patienten beobachtet, die die 120-mg-Dosierung von Denosumab bei bestehender Krebsdiagnose erhielten. Auch eine lange Therapiedauer, zusätzliche Belastungen durch Strahlentherapie im Kopf-Hals-Bereich, Chemotherapie, Komedikation mit Angiogenese-Hemmern oder bestehende Zahnerkrankungen werden als Risikofaktoren eingestuft. Vor Therapieeinleitung ist eine zahnärztliche Untersuchung durchzuführen. Größere invasive zahnärztliche Eingriffe sind während der Therapie generell zu vermeiden bzw. sollen, wenn nötig, in möglichst großem zeitlichem Abstand zur Denosumab-Gabe durchgeführt werden.
... atypische Frakturen
Die Ursache für die Bildung von atypischen Frakturen des Oberschenkelknochens ist nicht bekannt. Es wird vermutet, dass durch die antiresorptive Therapie der Knochenaufbau verändert wird und die natürliche Elastizität des Knochens ein Stück weit verloren geht. Da die unter Bisphosphonaten beobachteten Brüche häufig beidseitig stattfinden, ist auch die Untersuchung des kontralateralen Femurs angeraten, wenn eine solche Fraktur im Zusammenhang mit einer Denosumab-Therapie auftritt. Die Patienten sollen darauf hingewiesen werden, neu auftretende Schmerzen an Oberschenkel, Leiste oder Hüfte schnellstmöglich dem Arzt mitzuteilen. Muskuloskelettale Schmerzen scheinen eine sehr häufige unerwünschte Wirkung des Antikörpers zu sein. Nach Abklärung der Ursache muss gegebenenfalls erwogen werden, die Therapie abzusetzen.
Häufiger Infekte
Neben den oben genannten unerwünschten Effekten hat Denosumab auch Einfluss auf das Immunsystem. Das Abfangen von RANKL hemmt die Proliferation von T- und B-Lymphozyten und interagiert mit der Aktivierung dendritischer Zellen. Darauf beruht vermutlich die Tatsache, dass bei Anwendung von Denosumab vermehrt Infektionen der oberen Atemwege und der Harnwege auftreten. Zudem scheinen auch bakterielle Infekte des Unterhautgewebes und am Ohr zuzunehmen. In einzelnen Fällen wurde von der Entwicklung einer Pankreatitis berichtet. Wichtig ist dies vor allem bei immungeschwächten Patienten, bei denen eine sorgfältige Nutzen-Risiko-Abwägung getroffen werden muss. Derzeit existieren keine validen Daten bezüglich der Anwendung von Denosumab bei organtransplantierten oder aus anderen Gründen dauerhaft immunsupprimierten Patienten. In einer der Zulassungsstudien wurde zudem eine Häufung an Katarakten bei mit Denosumab therapierten Krebspatienten beobachtet. Ob hier ein kausaler Zusammenhang besteht, ist noch unklar.
Osteoporose und Biologicals: aktuelle Studienlage
Für die Bewertung der Wirksamkeit können neben der Bestimmung der Knochendichte auch Marker des Knochenumbaus (z. B. carboxyterminales quervernetztes Typ-1-Kollagen Telopeptid, CTX als Marker der Knochenresorption und Osteocalcin als Indikator für einen gesteigerten Knochenaufbau) herangezogen werden. Wichtigstes Kriterium ist natürlich die Abnahme von durch Osteoporose bedingten Brüchen der Wirbelkörper oder extravertebraler Knochen (Tab. 1). Durch rekombinantes Parathormon und Teriparatid können bei Patientinnen mit postmenopausaler Osteoporose vertebrale und nicht-vertebrale Frakturen mit Ausnahme von Oberschenkelbrüchen verringert werden. Die Knochenmineraldichte steigt an vielen Stellen, unter anderem an Lendenwirbelsäule und Oberschenkelknochen. Bei Männern mit Osteoporose konnte ebenfalls eine Zunahme der Knochenmineraldichte gezeigt werden, dies geht jedoch nicht mit einer signifikanten Reduktion der Frakturrate einher.
Wirkstoff |
Verminderung von Frakturen |
Mortalitäts-senkung |
||
|---|---|---|---|---|
vertebral |
nicht-vertebral |
Femur |
||
|
Alendronat
Risedronat
Zoledronat
|
A |
A |
A |
B |
Ibandronat |
A |
B |
– |
– |
Raloxifen |
A |
– |
– |
C |
Bazedoxifen |
A |
B |
– |
– |
PTH1-34(Teriparatid) |
A |
B |
– |
– |
Denosumab |
A |
A |
A |
B |
Strontium-Ranelat |
A |
A |
B |
– |
Für Denosumab liegen derzeit Acht-Jahres-Daten von postmenopausalen Patientinnen vor, welche die Zunahme der Knochendichte an Lendenwirbelsäule und Femur sowie die Abnahme von Frakturrate und Knochenumbaumarkern nachweisen. Für Männer mit Osteoporose ist die Zunahme der Knochendichte über einen Zwei-Jahres-Zeitraum publiziert. In einer kleinen Studie mit postmenopausalen Frauen wurde gezeigt, dass Denosumab und Teriparatid auf die Knochendichte additiv wirken, eine Kombination wird bisher nicht empfohlen, da es noch keine frakturbezogenen Daten gibt.
Die Auswirkungen, die eine Beendigung einer Denosumab-Behandlung von Osteoporose-Patienten hat, sind noch unzureichend untersucht. Bisherige Daten zeigen, dass die Effekte auf Knochendichte und Knochenumbau reversibel sind. 2016 publizierten Fallstudien zufolge traten bei mehreren Frauen gehäuft multiple Wirbelbrüche im Zeitraum von neun bis sechzehn Monaten nach dem Absetzen des RANKL-Antikörpers auf. Diese Beobachtung erfordert eine sorgfältige Nachkontrolle bei Beendigung der Behandlung. Für eine laufende Osteoporose-Therapie lässt sich ableiten, dass das Sechs-Monats-Intervall möglichst genau eingehalten werden soll.
Die Bewertung eines erhöhten Nutzens im Vergleich zu anderen antiosteoporotischen Therapien ist für beide Biologicals schwierig. Meist beruht ein direkter Vergleich zu mit Bisphosphonaten behandelten Patienten lediglich auf der Beurteilung der Knochenmineraldichte. Teriparatid scheint hinsichtlich des Auftretens neuer Wirbelfrakturen aber nicht in Bezug auf extravertebrale Frakturen bei Glucocorticoid-induzierter Osteoporose und bei postmenopausalen Frauen mit schwerer Osteoporose dem Komparator Alendronat überlegen zu sein. Eine antiresorptive Therapie mit Denosumab ist bezogen auf Veränderungen der Knochenresorptionsmarker und -mineralisationsdichte bei postmenopausaler Osteoporose besser wirksam als Ibandronat. Auch bei Patienten mit Knochenmetastasen zeigte sich eine Überlegenheit des Antikörpers im Vergleich zu Zoledronat im Hinblick auf die Vermeidung skelettbezogener Komplikationen.
Biologicals – die Zukunft
Biologicals sprießen wie Pilze aus dem Boden, sie sind teuer, und sie versprechen ungeahnte Möglichkeiten – gleichzeitig verwirren sie mit komplexen Wirkstoffbezeichnungen, mit ihrer Empfindlichkeit und unerwarteten Indikationsüberschneidungen.
Machen Sie sich vertraut mit diesen innovativen Arzneistoffen, indem Sie Grundkenntnisse zu Struktur und Herstellung aufpolieren, beispielhafte Indikationen und Targets kennenlernen und die Konsequenzen für das Handling in der Apotheke verstehen.
Biopharmazeutika liegen im Trend – daten Sie sich up!
Gerd Bendas, Martina Düfer
Update Biologicals
Rekombinante Proteine und ihr therapeutischer Einsatz. Update Pharmazie.
XII, 85 S., 42 farb. Abb., 2 Tab., kartoniert, 24,80 €
Deutscher Apotheker Verlag, Stuttgart 2016
ISBN 978-3-7692-6628-3
Einfach und schnell bestellen
Deutscher Apotheker Verlag, Postfach 10 10 61, 70009 Stuttgart
Tel. 0711 – 25 82 341, Fax: 0711 – 25 82 290
E-Mail: service@deutscher-apotheker-verlag.de
oder unter www.deutscher-apotheker-verlag.de
In der Pipeline: Antikörper gegen Sclerostin
Am weitesten fortgeschritten ist die klinische Prüfung der Sclerostin-Antikörper Romosozumab (Amgen) und Blosozumab (Eli Lilly). Sclerostin ist ein Glykoprotein, das von Osteozyten freigesetzt wird. Als endogener löslicher Hemmer des sogenannten Wnt/β-Catenin-Signalwegs blockiert Sclerostin die Osteoblasten-Bildung, ist also ein „Bremssignal“ der Knochenregeneration. Die Inaktivierung dieses Proteins ist, wie die intermittierende Gabe von Teriparatid, osteoanabol. In Phase-I-Studien konnte dieser knochenaufbauende Effekt an einem Anstieg der Knochenmineraldichte an postmenopausalen Frauen bzw. gesunden Männern gezeigt werden.
Fazit
Biologicals sind in der Therapie der Osteoporose etabliert und können den Krankheitsverlauf positiv beeinflussen. Es gibt sowohl Anzeichen für eine Überlegenheit gegenüber Bisphosphonaten als auch für einen sinnvollen Einsatz der Biologicals als Kombinationstherapie. Leider fehlen Studien mit frakturbezogenen Endpunkten, um den klinischen Nutzen für den Einzelnen noch besser abschätzen zu können. |
Literatur
bei der Verfasserin

























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.