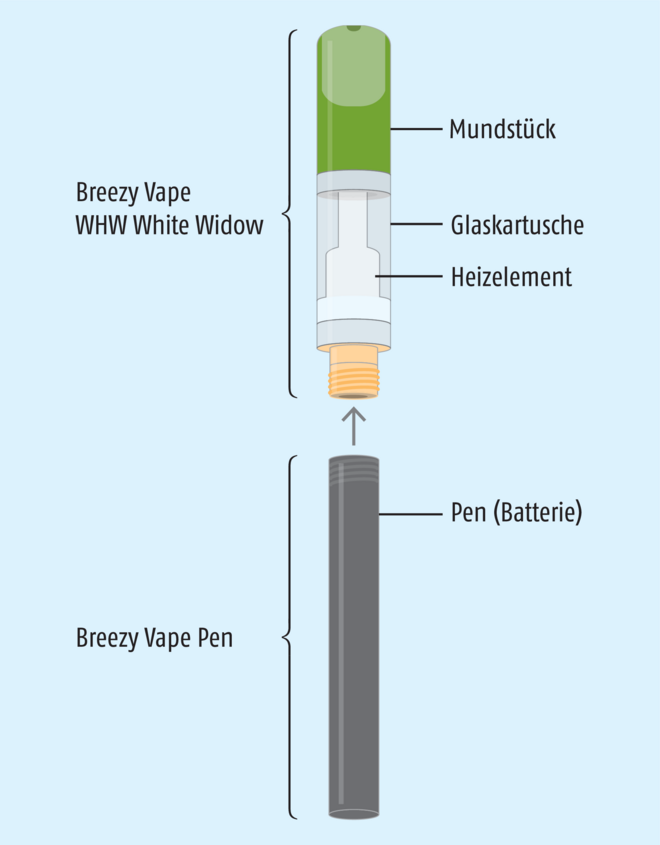
Worunter fällt dieser Vaporisator nun? Was ist die Kartusche – ein „kombiniertes Produkt“, ein Medizinprodukt oder Primärverpackung? Bei diesem Punkt unterscheidet sich die Einschätzung des Herstellers wesentlich von der Einschätzung Fabio Cirillos.
Auf Nachfrage der Redaktion erklärt die Ilios Santé GmbH: „Unser Produkt fällt unter das Arzneimittelgesetz und gilt in der Definition als Zubereitungsarzneimittel (s. auch Kasten „Zubereitungsarzneimittel – wie wird geprüft und hergestellt?“). Die Ausgangsstoffe dazu werden in einem GMP-zertifizierten Betrieb hergestellt und der Apotheke zur Verfügung gestellt“.
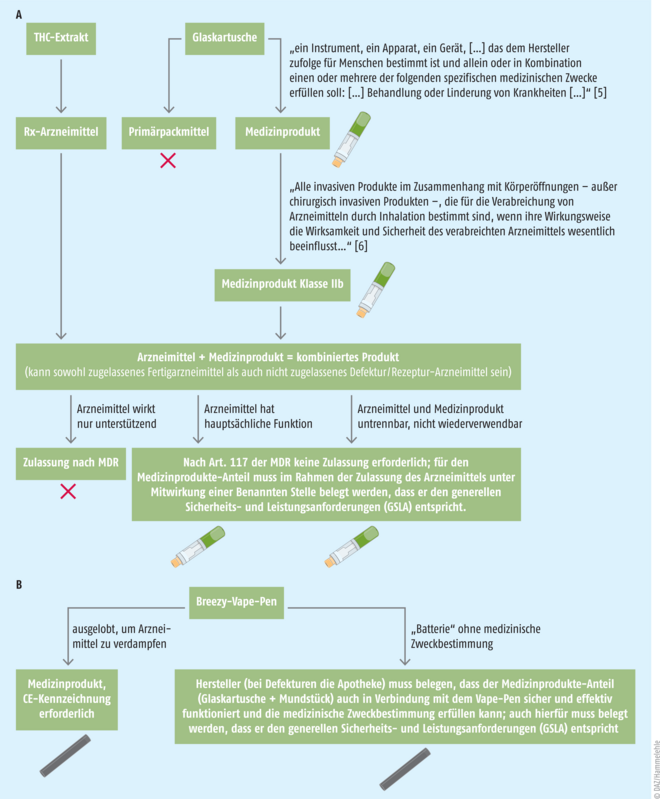
Der Hersteller erkennt in Breezy Vape weder ein kombiniertes Produkt noch ein Medizinprodukt: „Es ist kein Kombinationsarzneimittel, es handelt sich hierbei um Cannabis-haltigen Extrakt, der in eine Kartusche abgefüllt wurde. Unser Produkt entspricht der Definition Arzneimittel. Daher ist eine Zertifizierung gemäß MDR Art. 117 nicht notwendig.“ Und weiter: „Die Einschätzung, dass die Kartusche als Einzelnes ein Medizinprodukt ist, teilen wir nicht. Es ist vielmehr ein Primärpackmittel eines Rezeptur-Arzneimittels.“ Daher sieht der Hersteller auch kein Problem bei der apothekerlichen Abgabe: Da es sich bei Breezy Vape um ein „Arzneimittel, welches verschreibungspflichtig und damit auch apothekenpflichtig ist“ handle, sei „die Abgabe (…) ausdrücklich nur durch die Apotheke zulässig“, und „alle anderen Abgaben verstoßen gegen das Arzneimittelgesetz“, erklärt die Ilios Santé GmbH auf Nachfrage der DAZ.
Doch ist die Kartusche wirklich lediglich eine Verpackung oder nicht doch ein Medizinprodukt? Liest man in der Verordnung (EU) 2017/745 des Europäischen Parlaments und des Rates vom 5. April 2017 über Medizinprodukte in Art. 2 „Begriffsbestimmungen“ nach, bezeichnet der Begriff „Medizinprodukt“ unter anderem „ein Instrument, einen Apparat, ein Gerät, eine Software, ein Implantat, ein Reagenz, ein Material oder einen anderen Gegenstand, das dem Hersteller zufolge für Menschen bestimmt ist und allein oder in Kombination einen oder mehrere der folgenden spezifischen medizinischen Zwecke erfüllen soll:
- Diagnose, Verhütung, Überwachung, Vorhersage, Prognose, Behandlung oder Linderung von Krankheiten,
- Diagnose, Überwachung, Behandlung, Linderung von oder Kompensierung von Verletzungen oder Behinderungen …“ [5].
„Es ist klar ersichtlich, dass die Kartusche für einen Menschen (Patienten) ausgelobt ist und durch das Mundstück ein Arzneimittel zur Behandlung abgegeben wird“, sagt Fabio Cirillo dazu. Seine Einschätzung, dass es sich bei der Kartusche damit um ein Medizinprodukt oder einen Medizinprodukte-Anteil eines Kombinationsproduktes handelt, verdeutlichen Cirillo zufolge zusätzlich die Klassifizierungsregeln in Annex VIII, Kapitel 3 der MDR, wo es um die Invasivität von Produkten geht: „Dort steht, dass ein Produkt zum Eindringen oder Einbringen in eine natürliche Körperöffnung ein invasives Medizinprodukt darstellt.“ Relevant für Breezy Vape ist hier in erster Linie Regel 20: „Alle invasiven Produkte im Zusammenhang mit Körperöffnungen – außer chirurgisch-invasiven Produkten –, die für die Verabreichung von Arzneimitteln durch Inhalation bestimmt sind, gehören zur Klasse IIa, es sei denn, ihre Wirkungsweise beeinflusst die Wirksamkeit und Sicherheit des verabreichten Arzneimittels wesentlich oder sie sind für die Behandlung lebensbedrohlicher Umstände bestimmt; in diesem Fall werden sie der Klasse IIb zugeordnet.“ [6]
Dann müsste es sich folglich bei Breezy Vape um ein kombiniertes Produkt mit dem Arzneimittel „Cannabis-Extrakt“ und dem Medizinprodukte-Anteil „Kartusche“ handeln. Das bestätigt auch Fabio Cirillo: Kombinationsprodukt? „Ja“.































0 Kommentare
Das Kommentieren ist aktuell nicht möglich.