
- DAZ.online
- DAZ / AZ
- DAZ 9/2021
- Ist die Politik ...
Lieferengpässe
Ist die Politik aufgewacht?
Arzneimittellieferengpässe: eine Bestandsaufnahme über begonnene Gegenmaßnahmen
Im Rahmen der FAZ-Digitalkonferenz „Für ein gesundes Europa“ am 7. Oktober 2020 in Berlin nutzte der proGenerika e. V. die Bühne auch für die Vorstellung einer Studie der Beratung MundiCare Life Sciences Strategies unter dem Titel „Woher kommen unsere Wirkstoffe? Eine Weltkarte der API Produktion“. Bei der Durchführung dieser Studie fokussierte sich die Arbeitsgruppe auf die Auswertung anhand der CEP-Datenbank des EDQM und analysierte deren Entwicklung für 565 ausgewählte generische Wirkstoffe im Zeitraum 2000 bis 2020 (Erklärung der Abkürzungen s. Kasten auf folgender Seite). Dass die Arzneimittellieferengpässe auch auf höchster politischer Ebene angekommen sind, drückt sich schon bei der Lektüre des Rednerpanels der Digitalkonferenz aus, eröffnet vom Bundesminister für Gesundheit Jens Spahn und Redebeiträgen von Tiemo Wölken (Mitglied des Europäischen Parlaments) und Thierry Breton dem EU-Kommissar für den Binnenmarkt.
Certificate of Suitability to the monographs of the European Pharmacopoeia (CEP)
CEPs können vom Wirkstoffhersteller beim Europäischen Direktorat für die Qualität von Arzneimitteln (EDQM) beantragt werden. Voraussetzung für die Erteilung eines CEP ist, dass es sich um einen im Europäischen Arzneibuch (Ph. Eur.) monographierten Wirkstoff handelt. Ein erteiltes CEP belegt, dass eine Monographie der Ph. Eur. dazu geeignet ist, die Qualität des Wirkstoffs angemessen zu prüfen.
Um ein CEP zu erhalten, muss der betreffende Wirkstoffhersteller eine detaillierte Beschreibung seines Herstellungsprozesses und der dabei anfallenden Verunreinigungen sowie deren mögliche toxikologische Charakterisierung einreichen. Wirkstoffgehalt und Verunreinigungsprofil müssen mittels der monographierten Analysenmethoden nachgewiesen werden können. Wird ein CEP erteilt, bescheinigt es dem Wirkstoffhersteller, dass der Wirkstoff durch die Monographie der Ph. Eur. ausreichend kontrolliert wird, was die Grundvoraussetzung für den Welthandel mit diesen Feinchemikalien ist. Das CEP-Verfahren existiert erst seit 1994 (Weidenauer 2020).
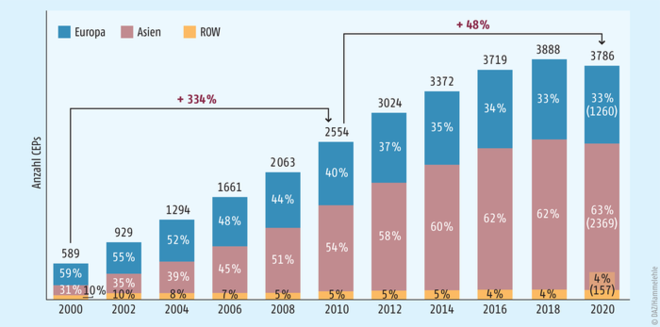
Während in 2000 noch rund 60 Prozent der CEPs von europäischen (348 CEPs) und lediglich 31 Prozent von asiatischen Wirkstoffherstellern (138 CEPs) gehalten wurden, hat sich das Verhältnis bis 2020 umgekehrt und rund 2/3 der CEPs werden von asiatischen Wirkstoffherstellern gehalten (Europa 1260 vs. Asien 2369). Bemerkenswerterweise ist dabei die Gesamtanzahl der im Rahmen der Studie bewerteten CEPs von 589 auf 3788 angestiegen (s. Abb. 1). Diese Zahl darf nicht fehlinterpretiert werden: Für einen Wirkstoff können im Prinzip beliebig viele CEPs erteilt werden, d. h. es treten immer wieder neue Wirkstoffhersteller an das EDQM heran und beantragen ein CEP für einen existierenden generischen Wirkstoff und erhalten mit der Erteilung die prinzipielle Möglichkeit, diese Feinchemikalien an europäische pharmazeutische Unternehmer zu verkaufen, damit diese sie in ihre Zulassung und schlussendlich Marktversorgung einbinden.
Abb. 1: Mit Einführung der CEP-Prozedur im Jahr 1994 nutzen vornehmlich Europäische Wirkstoffhersteller dieses Verfahren und erlangten CEPs. Mit dem zunehmenden Wirtschaftswachstum in Asien und der wachsenden Dominanz der generischen Pharmaindustrie, größtenteils ohne eigene Wirkstoffsynthese, veränderte sich das Verhältnis von asiatischen zu europäischen CEP-Haltern gravierend: Während 2000 rund ⅔ der CEPs von europäischen und nur knapp ⅓ von asiatischen Firmen gehalten wurden, ist das Verhältnis in 2020 gekippt und rund ⅔ der erteilten CEPs sind in asiatischer Hand (ROW: restliche Welt).
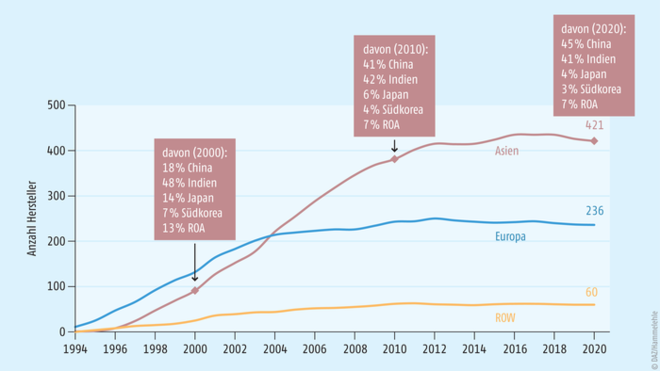
Ein bedenklicher Befund sind die beobachteten Konzentrationseffekte: so existiert für rund 1/6 der untersuchten Wirkstoffe gar keine europäische Produktion mehr, während die Wirkstoffproduktionen in Asien im Wesentlichen in China und Indien angesiedelt sind. In den beiden Ländern konzentrieren sich die Wirkstoffproduktionen regional auf nur wenige Provinzen und auch Wirkstoffhersteller. Entsprechend ist die Anzahl an Wirkstoffherstellern in Europa seit den frühen 2000er-Jahren stagnierend, während dieses Industriesegment in Asien rasant gewachsen ist. Rund doppelt so viele Wirkstoffhersteller produzieren die betrachteten Wirkstoffe in Asien (421) wie in Europa (236), wobei auch in Asien der Zuwachs seit den 2010er-Jahren auf stabilem Niveau stagniert (s. Abb. 2). Daraus lässt sich ableiten, dass sich die immer noch zunehmende Anzahl an CEPs bei den Wirkstoffherstellern konzentrieren, die sich sowohl technologisch als auch von ihrem Absatzsegment weiter spezialisieren und somit Skalen- und Kosteneffekte nutzen.
Abb. 2: Anstieg der Anzahl an Wirkstoffherstellern innerhalb Europas und Asiens. Die Anzahl an europäischen Wirkstoffherstellern stagniert bereits Anfang der 2000er-Jahre und wird von der stark wachsenden Anzahl asiatischer Wirkstoffhersteller überholt. Anfang der 2010er-Jahre stagniert auch die Anzahl asiatischer Wirkstoffhersteller und stabilisiert sich, was auch auf eine zunehmende Konzentration von CEPs bei einzelnen Unternehmen schließen lässt (ROA: restliches Asien, ROW: restliche Welt).
Technologisch gesehen fokussieren sich die asiatischen Lieferanten eher auf preisgünstige Massenprodukte, d. h. die eher mit einfachen Synthesen und in größeren Mengen hergestellt werden. Während sich die europäischen Wirkstoffhersteller auf die eher komplexeren Prozesse bzw. Moleküle spezialisiert haben, die in eher geringeren Mengen produziert werden. Bemerkenswert ist auch, dass für detailliert untersuchte Wirkstoffe entweder die Versorgung nahezu komplett aus Europa oder aus Asien erfolgte. Eine Mischung, die eine gegenseitige Kompensation des Ausfalls einer Produktionsregion erlauben würde, ist somit in der Regel ausgeschlossen. Spätestens seit der Corona-Pandemie und den Lockdowns in einzelnen Städten und Regionen ist dies kein theoretisches Szenario mehr. Zudem führten in der Vergangenheit Ausfälle bei einzelnen Wirkstoffherstellern bereits zu globalen Verknappungen von Wirkstoffen.
Im Übrigen ein Phänomen, dass keineswegs spezifisch für den Pharmamarkt ist und im Prinzip in vielen Bereichen der Industrieproduktion beobachtet wird. Die Automobilproduktion zum Beispiel stand im Frühjahr 2020 quasi still, da Zuliefererteile aus Asien und anderen Weltregionen ausfielen. Die Fahrradindustrie rechnet erst 2022 mit einer Entspannung der Lieferkettensituation und die Händler stehen vor leeren Lagerhallen für an sich stark nachgefragten Produkte wie E-Bikes und „klassische“ Fahrräder.
Ein zu erwartender Befund für die wesentlichen Treiber dieser Veränderungen waren die hohen und die stetig wachsenden regulatorischen Rahmenbedingungen und der steigende Kostendruck. Hier bestand ein breiter Konsens unter den Konferenz-Teilnehmern sowie der Interview-Partner für die MundiCare-Studie. Interessanterweise berichtete Minister Jens Spahn, dass man sich bei der Einführung der Rabattverträge im Rahmen der Gesundheitsreformen von Regierungsseite wesentlich geringere Einsparungen erhofft hatte. Die pharmazeutischen Unternehmer haben sich mit Einführung dieses Mechanismus in den Preisen einen harten Wettbewerb geliefert, der offensichtlich eine Preisabwärtsspirale ausgelöst hat, aus der zunehmend mehr westliche pharmazeutische Unternehmen aussteigen, deren Stelle zunehmend von indischen Konzernen eingenommen wird.
Kritische Sichtweise auf die CEP-Prozedur
Die CEPs bestehen aus zwei Teilen, zum einen dem sogenannten applicants part („open part“) und zum anderen dem restricted part („closed part“). Der applicants part legt die wesentlichen Informationen für den Kunden, also den pharmazeutischen Unternehmer offen, der den eingesetzten Wirkstoff auf Basis der analytischen Methoden der Ph. Eur. analysiert und auf Basis dieser Daten die Freigabe für das Fertigarzneimittel macht.
Im restricted part werden schützenswerte Informationen beschrieben, wie der detaillierte Herstellungsprozess, spezielle Prozessschritte etc. Somit können Firmengeheimnisse im Zusammenhang mit Herstellung und Verarbeitung der Wirkstoffe geheim gehalten werden und sind lediglich der überwachenden Institution EDQM und nicht für Kunden oder Konkurrenten zugänglich. Der Wirkstoffhersteller beschreibt diese Informationen im sogenannten CTD-Format (Common Technical Document-Format), was dem Standard der Zulassungen für unsere Fertigarzneimittel entspricht. Somit können definierte Teile des Wirkstoffherstellers direkt und geschützt in das Zulassungsdossier des pharmazeutischen Unternehmers übernommen werden. Die Dokumentation des Wirkstoffherstellers ist als ein essenzieller Teil der Zulassungsdokumentation zu sehen und der eingesetzte Wirkstoff als wesentliche therapeutische Komponente unserer generischen Arzneimittel, die im Moment rund 79 Prozent der Arzneimittelversorgung in Deutschland ausmachen, bezogen auf die therapeutischen Tagesdosen.
Die pharmazeutischen Unternehmer wie das EDQM müssen zum einen ein großes Vertrauen in die liefernden Wirkstoffhersteller und zum anderen ein funktionierendes Überwachungssystem entwickeln. Verändert der Wirkstoffhersteller seinen Herstellungsprozess, kann sich ein verändertes Verunreinigungsprofil ergeben, das mit den analytischen Methoden der Ph. Eur. nicht mehr erfasst werden kann. So geschehen bei den entdeckten potenziell kanzerogenen Verunreinigungen in Valsartan-Fertigarzneimitteln: Die chinesischen Wirkstoffhersteller Zhejiang Huahai Pharmaceutical und Zhejiang Tianyu sowie der indische Wirkstoffhersteller Hetero Labs Limited sind vom genehmigten Herstellungsverfahren abgewichen und die routinemäßig eingesetzten analytischen Methoden der Ph. Eur. waren nicht geeignet, diese Verunreinigungen zu detektieren. Zum anderen wurden neben den beschriebenen Verstößen gegen den genehmigten restricted part des CEPs auch gegen die Vorschriften der Guten Herstellungspraxis (GMP) verstoßen, die seit einigen Jahren auch für Wirkstoffhersteller gelten. Fragwürdig ist es sowieso, wie man in einem totalitären Regime wie China Wirkstoffhersteller adäquat überwachen soll, wenn man sich z. B. für einen Audit vorab anmelden muss oder dieser während der Pandemie gar nicht möglich ist?!
Wege aus der Krise
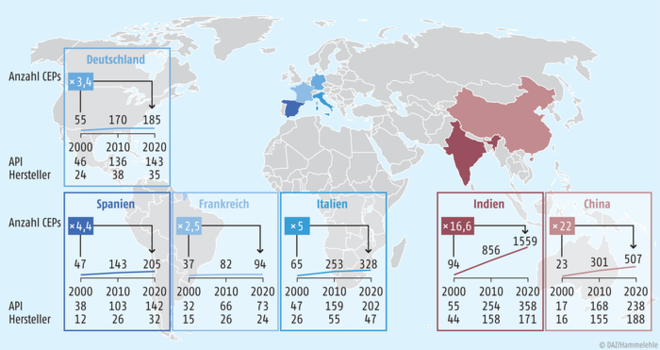
Einig war man sich auf der FAZ-Konferenz darüber, dass man weg muss von immer niedrigeren Preisen hin zu einer soliden und (vielleicht sogar transparent) nachvollziehbaren Lieferkette für unsere Fertigarzneimittel. Positiv zu sehen ist es, dass noch rund ein Drittel der Wirkstoffe in Europa produziert werden und die Kernkompetenzen innerhalb der Europäischen Union (EU) vorhanden sind. Zudem ist auch innerhalb der EU eine deutliche Steigerung der Anzahl an CEPs über den Untersuchungszeitraum der MundiCare-Studie zu beobachten (s. Abb. 3).
Abb. 3: Anstieg der Anzahl an erteilten CEPs innerhalb der wichtigsten Weltregionen: In den EU-Ländern mit hoher Wirkstoffsynthesekompetenz hat sich die Anzahl in den 20 Jahren der MundiCare-Studie um den Faktor 2,5 (Frankreich) bis 5,0 (Italien) gesteigert. Die wichtigsten asiatischen Länder, China und Indien, konnten im gleichen Zeitraum ihre Anzahl an CEPs wesentlich stärker steigern (Vervielfachung um Faktor 16,6 in Indien und 22 in China).
Vorgehen beim Aufbau neuer europäischer Wirkstoffhersteller
In einem ersten Schritt ist es wichtig, Prioritäten zu setzen. Es sollten zunächst besonders versorgungskritische bzw. therapeutisch essenzielle Wirkstoffe bevorzugt werden und deren Produktion wieder in der EU ermöglicht werden. Länder mit hohem chemischen Know-how und einer gut ausgeprägten Wirkstoffsynthese sind neben Deutschland auch das Nachbarland Frankreich sowie Italien und Spanien. Selbstverständlich sollte die Schweiz, zwar nicht in der EU, aber geografisch im Herzen Europas und mit einer global sehr stark aufgestellten chemisch/pharmazeutischen Industrie, als Partner für solche Vorhaben nicht außer Acht gelassen werden.
Licht am Ende des Tunnels
Als wichtige Initiative ist sicherlich die Aktivität des Schweizer Novartis-Konzerns zu nennen, der sich entschlossen hat, das Betalactam-Antibiotika-Geschäft der Division Sandoz zu stärken. Neben einer Investition von rund 100 Mio. Euro investiert auch das Land Österreich rund 50 Mio. Euro in den Ausbau und Erhalt der Einheit am Standort in Kundl im Bundesland Tirol. Ein wichtiges Bekenntnis zur EU-Antibiotika-Produktion, da das Geschäft von mehreren Standorten betrieben wird, neben Österreich auch in Frankreich, Spanien und ehemals Deutschland. Ein Erhalt dieses Geschäftes sichert die langfristigen Produktions- und Entwicklungskompetenzen von essenziellen Antibiotika im Herzen der EU. Der Frankfurter Standort der Sandoz-Division musste übrigens unter dem Kostendruck der asiatischen Produzenten bereits verkauft und kurz darauf geschlossen werden. Ein Indiz dafür, dass es höchste Zeit ist, jetzt zu handeln!
Sanofi als größter französischer Pharmakonzern mit einer starken internen Wirkstoffproduktion hat bereits einen Ausbau seiner Chemiesynthese-Aktivitäten angekündigt, um die enorme Abhängigkeit von asiatischen Produzenten zu reduzieren.
Zum Weiterlesen
Einblick in verschlossene Welten – Umdenken gefragt?
„Ihr Arzneimittel ist leider nicht lieferbar.“ Dieser Satz gehört mittlerweile zum Standardrepertoire des deutschen Apothekenpersonals. Ein gravierendes, stetig wachsendes Problem. Plötzlich sind wichtige Güter nicht mehr selbstverständlich. Heute wird bewusst, dass Arzneimittel nicht aus deutschen Fabriken stammen, sondern Endprodukte globaler Handelsketten sind. Viele wichtige Arzneistoffe kommen längst aus Asien.
Die Globalisierung hat auch vor der Pharmazie nicht Halt gemacht. Vieles, was sich in fernen Märkten abspielt, beeinflusst die Verfügbarkeit eines bestimmten Fertigarzneimittels in der Bundesrepublik.
Aber warum ist das so? Und vor allem, was kann dagegen getan werden?
Dieses Werk will Apothekenpersonal helfen, auf die täglichen Fragen von Kunden, Pflegediensten, Arztpraxen und Krankenkassen, plausible Antworten zu geben.
Uwe Weidenauer
Nicht lieferbar!
Ausverkauf des Deutschen Arzneimittelmarkts
123 S., 19,80 Euro
32 farb. Abb., 20 farb. Tab.,
17,0 × 24,0 cm, Kartoniert
ISBN 978-3-7692-7613-8
Deutscher Apotheker Verlag, 2020
Einfach und schnell bestellen
Deutscher Apotheker Verlag, Postfach 10 10 61, 70009 Stuttgart
Tel. 0711 2582-341, Fax: 0711 2582-290
E-Mail: service@deutscher-apotheker-verlag.de
oder unter www.deutscher-apotheker-verlag.de
Fazit
In der Zeit nach der Corona-Pandemie wird es eine entscheidende Rolle spielen, inwieweit die EU in der Lage ist, neue Arbeitsplätze zu schaffen und daraus wieder ein Wirtschaftswachstum zu erzeugen. Eine Stärkung der Wirkstoffproduktion bietet Chancen auf neue Arbeitsplätze, die gerade in den von Wirtschafts- und Corona-Krise stark betroffenen Ländern Frankreich, Italien und Spanien dringend gebraucht werden. Zu erwarten wären zwei synergistische Effekte: zum einen eine erhöhte Versorgungssicherheit durch eine Wirkstoffproduktion im EU-Binnenmarkt und zum anderen ein wieder wachsendes Industriesegment, welches eine wirtschaftliche Perspektive für viele junge und gut ausgebildete EU-Bürger ist, die zurzeit kaum Chancen am heimischen Arbeitsmarkt haben. |
Literatur
EDQM (2021). „CEP Datenbank.“ from https://extranet.edqm.eu/publications/recherches_CEP.shtml
Meiser A. (2020). Woher kommen unsere Wirkstoffe? Eine Weltkarte der API Produktion, progenerica e. V.
proGenerika (2019). Generika in Zahlen (jährlich erscheinender Bericht zu den generischen Marktzahlen), proGenerika e. V.
Sucker-Sket K. (2018). Der Valsartan Fall: „Das EDQM muss seine Hausaufgaben machen“. DAZ.online vom 23.08.2018
Weidenauer U. (2020). Nicht lieferbar! Ausverkauf des Deutschen Arzneimittelmarkts, Deutscher Apotheker Verlag






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.