- DAZ.online
- DAZ / AZ
- DAZ 3/2010
- Impfversagen durch ...
Praxis aktuell
Impfversagen durch Analgetika?
In einer kürzlich in Lancet erschienen Studie von Prymula et al. wurde nun erstmalig nicht nur die Wirkung das Analgetikums Paracetamol (USAN: Acetaminophen) auf die Nebenwirkungen von Impfungen, sondern auch auf die Hauptwirkung, die Ausbildung eines ausreichenden Antikörpertiters, untersucht [Prymula et al., 2009]. Demnach kam es bei den meisten Impfstoffen bei Kombination mit Paracetamol zu einer verminderten Antikörpertiterbildung.
Welche Relevanz hat das Ergebnis dieser Studie? Folgende Fragen stellen sich zu diesem Problemkomplex:
- Reduziert Paracetamol die Inzidenz von vergleichsweise harmlosen Nebenwirkungen der Impfreaktion wie Fieber und Schmerzen?
- Reduziert Paracetamol die Inzidenz von Fieberkrämpfen nach Impfungen von Kindern?
- Führt Paracetamol zu einer klinisch relevanten Reduktion der erwünschten Immunantwort nach Impfung und wie ist diese Reduktion biochemisch-mechanistisch zu erklären?
- Ist davon auszugehen, dass auch andere Analgetika/Antipyretika die Immunantwort abschwächen?
Zu den ersten beiden Fragen wurde bereits von Prymula et al. Stellung genommen. Demnach ist die Rate der meisten Nebenwirkungen, insbesondere Fieber, bei prophylaktischer Paracet-amolgabe geringer (Tab. 1). Ob auch die Inzidenz von Fieberkrämpfen gesenkt wird, kann jedoch aus den vorliegenden Daten aufgrund der zu geringen Fallzahl nicht abgelesen werden.
Reduktion der Immunantwort: klinisch relevant?
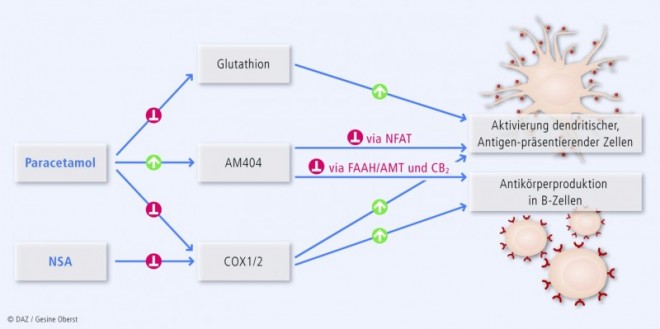
Der exakte Wirkungsmechanismus von Paracetamol ist nach wie vor unklar. Es wurden mehrere möglicherweise analgetische Effekte beschrieben, die auch die Immunreaktion beeinträchtigen, unter anderem eine zentralnervöse COX-2-Hemmung und Stimulation des Endocannabinoid-Systems. Außerdem führt der Verbrauch von Glutathion durch Paracetamol zu Asthma und Lebertoxizität [Bertolini et al., 2006, Smith, 2009; s. auch Herdegen, MMP 2009] (Abb.).
Intaktes COX-2 ist wichtig für eine normale Immunreaktion (Ryan et al., 2005). Der Aufbrauch des Glutathionpools kann neben der COX-Enzymaktivität auch die Immunantwort abschwächen [Herzenberg et al., 1997, Jakobsson et al., 1999]. Aktivierung von CB2 -Cannabinoidrezeptoren hemmt Zellen des Immunsystems [Eisenstein et al., 2007, Jan et al., 2007]. Der Paracetamol-Metabolit AM404 kann indirekt über das Endocannabinoidsystem oder direkt T-Zellen hemmen [Caballero et al., 2007]. Somit gibt es – neben der COX-2-Hemmung – mehrere Erklärungsansätze, wie Paracetamol auf eine spezifische Art das Immunsystem schwächen kann, die nicht von anderen NSA geteilt wird (Abb.).
Wie verhalten sich andere Analgetika?
Wie ist die Situation bei den klassischen COX-Hemmern wie z. B. ASS, Diclofenac, Ibuprofen und den neueren Coxiben? Prostaglandine sind seit vielen Jahren als Transmitter von Immunzellen bekannt [Rocca and FitzGerald, 2002]. In vitro und in vivo wurde gezeigt, dass beide Cyclooxigenase-Isoformen COX-1 und COX-2 wichtig für eine korrekte Immunantwort sind und dass ASS und andere NSA immunodepressiv wirken können (Tab. 2) [Bancos et al., 2009, Bernard et al., 2009, Blaho et al., 2009, Morris et al., 2009]. Allerdings gibt es Widersprüche zwischen den einzelnen Arbeiten: Blaho et al. wiesen z. B. nur für COX-1, nicht aber COX-2, eine Beteiligung bei der Antikörperproduktion nach. Außerdem werden häufig Stimulanzien genutzt, die – im Gegensatz zu den momentan verwendeten Adjuvanzien – ihre Wirkung über Toll-like-Rezeptoren entfalten. Das Ausmaß der Immunmodulation in der Praxis ist jedoch nur unzureichend untersucht. Wünschenswert wären Kohortenstudien und Analysen von Spontanmeldungen zu diesem Sachverhalt.
Impfantwort und -reaktion sind nicht zu trennen
Zusammenfassend ist festzuhalten, dass die von COX-1/2 abhängigen febrilen und immunaktivierenden Komponenten einer Entzündung, wie sie auch beim Impfen auftreten, gegenwärtig nicht zu trennen sind bzw. pharmakologisch nicht separat gehemmt werden können. Bei COX- bzw. Prostaglandin-abhängigen Antipyretika sind Abschwächungen der Impfantwort zu erwarten. Ob diese Abschwächung automatisch einen mangelhaften Impfschutz bedeutet, ist eine andere noch unbeantwortete Frage. Prymula et al. konnten unter Paracetamol nur für Haemophilus influenzae und einige Pneumokokken-Subtypen eine eventuell biologisch relevante Einschränkung der Impfantwort zeigen.
Fazit für die Praxis
Die prophylaktische Gabe von Paracetamol und anderen NSA sollte unterbleiben, da sie nicht notwendig ist und mit der Impfantwort interferieren kann. Im Gegensatz schwächt die zielgerichtete Gabe nach Auftreten der Symptome, also nach der frühen Aktivierung der dendritischen Zellen, die Impfreaktionen ebenso wirksam ab, lässt aber die Impfantwort intakt.
LiteraturACIP, 1987. Pertussis immunization; family history of convulsions and use of antipyretics-supplementary ACIP statement. MMWR Morb Mortal Wkly Rep. 36, 281 – 282.Bancos, S., Bernard, M. P., Topham, D. J. and Phipps, R. P., 2009. Ibuprofen and other widely used non-steroidal anti-inflammatory drugs inhibit antibody production in human cells. Cell Immunol. 258, 18 – 28.Bernard, M. P.et al., 2009. Chronic inhibition of cyclooxygenase-2 attenuates antibody responses against vaccinia infection. Vaccine.Bertolini, A., et al., 2006. Paracetamol: new vistas of an old drug. CNS Drug Rev. 12, 250 – 275.Blaho, V. A., Buczynski, M. W., Dennis, E. A. and Brown, C. R., 2009. Cyclooxygenase-1 orchestrates germinal center formation and antibody class-switch via regulation of IL-17. J Immunol. 183, 5644 – 5653.Caballero, F. J., et al., 2007. The acetaminophen-derived bioactive N-acylphenolamine AM404 inhibits NFAT by targeting nuclear regulatory events. Biochem Pharmacol. 73, 1013 –1023.Eisenstein, T. K., Meissler, J. J., Wilson, Q., Gaughan, J. P. and Adler, M. W., 2007. Anandamide and Delta9-tetrahydrocannabinol directly inhibit cells of the immune system via CB2 receptors. J Neuroimmunol. 189, 17 – 22.Herdegen, T., 2009. Erhöhte Inzidenz von Asthma bronchiale durch Paracetamol Med. Mo. Pharm. 32, 231 – 233.Herzenberg, L. A., De Rosa, S. C., Dubs, J. G., Roederer, M., Anderson, M. T., Ela, S. W. and Deresinski, S. C., 1997. Glutathione deficiency is associated with impaired survival in HIV disease. Proc Natl Acad Sci U S A. 94, 1967 –1972.Jakobsson, P. J., Thoren, S., Morgenstern, R. and Samuelsson, B., 1999. Identification of human prostaglandin E synthase: a microsomal, glutathione-dependent, inducible enzyme, constituting a potential novel drug target. Proc Natl Acad Sci U S A. 96, 7220 – 7225.Jan, T. R., Su, S. T., Wu, H. Y. and Liao, M. H., 2007. Suppressive effects of cannabidiol on antigen-specific antibody production and functional activity of splenocytes in ovalbumin-sensitized BALB/c mice. Int Immunopharmacol. 7, 773 – 780.Morris, T., Stables, M., Hobbs, A., de Souza, P., Colville-Nash, P., Warner, T., Newson, J., Bellingan, G. and Gilroy, D. W., 2009. Effects of low-dose aspirin on acute inflammatory responses in humans. J Immunol. 183, 2089 – 2096.Prymula, R., Siegrist, C. A., Chlibek, R., Zemlickova, H., Vackova, M., Smetana, J., Lommel, P., Kaliskova, E., Borys, D. and Schuerman, L., 2009. Effect of prophylactic paracetamol administration at time of vaccination on febrile reactions and antibody responses in children: two open-label, randomised controlled trials. Lancet. 374, 1339 –1350.Rocca, B. and FitzGerald, G. A., 2002. Cyclooxygenases and prostaglandins: shaping up the immune response. Int Immunopharmacol. 2, 603 – 630.Ryan, E. P., Pollock, S. J., Murant, T. I., Bernstein, S. H., Felgar, R. E. and Phipps, R. P., 2005. Activated human B lymphocytes express cyclooxygenase-2 and cyclooxygenase inhibitors attenuate antibody production. J Immunol. 174, 2619 – 2626.Smith, H. S., 2009. Potential analgesic mechanisms of acetaminophen. Pain Physician. 12, 269 – 280.
AutorenProf. Dr. med. Thomas Herdegen Ruwen BöhmInstitut für Experimentelle und Klinische Pharmakologie, Universitäts-Klinikum Schleswig-Holstein – Campus Kiel, Hospitalstraße 4, 24105 Kiel
Tab. 1: Prophylaktische Paracetamol-Gabe: Impfnebenwirkungsraten in der Paracetamol- und Kontrollgruppe. | ||
Impfreaktionen |
Paracetamol |
Kontrolle |
Fieber 38°C - 39,5°C |
42% (94/226) * |
66% (154/233) |
Fieber > 39,5°C |
< 1% (1/226) n.s. |
1% (3/233) |
Fieberkrämpfe |
0 n.s. |
0 |
Tab. 2: Studienlage zu COX-Hemmung und Immunsystem | ||||
Studie |
Typ |
Stimulus |
COX-Hemmung |
Ergebnis |
(Bancos et al., 2009) |
in vitro (humane B-Zellen, Maussplenocyten) |
CpG 2395, LPS |
pharmakologisch (Ibuprofen, Paracetamol, ASS,
Naproxen,
SC-58125, Indomethacin), genetisch (cox2-/-Mäuse)
|
weniger IgG- und IgM- Produktion |
(Bernard et al., 2009) |
in vivo (Maussplenocyten) |
Vacciniavirus |
pharmakologisch (SC-58125, NS-398), genetisch (cox2-/-Mäuse) |
weniger Ig-Klassenwechsel, verminderte IgG2a
-Titer; v.a. bei chronischer COX2-Hemmung |
(Blaho et al., 2009) |
in vitro und in vivo (Maussplenocyten) |
B. burgdorferi
- Antigen |
pharmakologisch (Celecoxib, SC-560), genetisch (cox1-/- und cox2-/-Mäuse) |
unter COX1-, aber nicht COX2-Hemmung weniger Ig-Klassenwechsel, verminderte Produktion von IL-6 und IL-17 |
(Morris et al., 2009) |
in vivo und in vitro (Menschen, humane Leukozyten, Mäuse) |
Cantharidin, Zymosan |
ASS (75 mg oder 1 g) |
schon niedrigdosiertes ASS hemmt über einen möglicherweise COX-unabhängigen Weg Leukozyten-Endothel-Interaktionen und ist anti-inflammatorisch |
(Ryan et al., 2005) |
in vitro (humane B-Zellen) |
CD40L, S. aureus -Antigen |
pharmakologisch (Indometacin, SC-58125, NS-398) |
verminderte IgM- und IgG-Produktion; leicht verminderte B-Zell-Proliferation |
CpG 2395 (Oligodesoxynukleotid), LPS (Lipopolysaccharide, Bestandteil der bakteriellen Zellwand, Zymosan (Bestandteil der Hefezellmembran): Aktivatoren von Toll-like-Rezeptoren; Cantharidin: zytotoxischer Wirkstoff mit unklarem Wirkmechanismus; SC-58125, SC-560, NS-398: COX-2-Inhibitoren; ASS: Acetylsalicylsäure; IgG2a: Immunglobuline mit γ-2a-Ketten | ||||

0 Kommentare
Das Kommentieren ist aktuell nicht möglich.