
- DAZ.online
- News
- Pharmazie
- Donanemab – dritter ...
Anti-Amyloid-Antikörper verlangsamt kognitiven Verfall
Donanemab – dritter Alzheimer-Antikörper in den Startlöchern?
12.05.2023, 09:15 Uhr
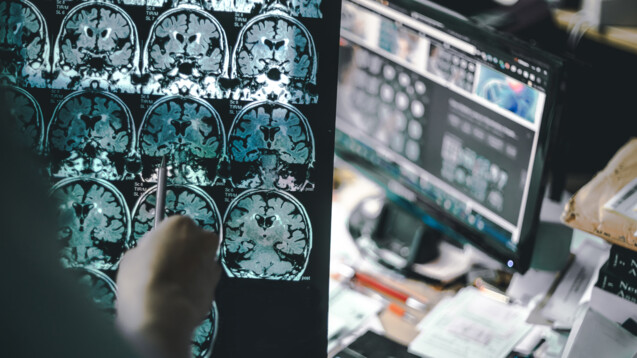
Vorsicht Nebenwirkungen: Sogenannte Amyloid-Related Imaging Abnormalities, kurz ARIA, treten als unerwünschte Veränderungen in MRT-Scans unter Therapie mit Anti-Amyloid-Antikörpern auf. (Symbolfoto: Atthapon / AdobeStock)
Eli Lilly hat erste Ergebnisse der Phase-III-Studie TRAILBLAZER-ALZ 2 mit dem Anti-Amyloid-Antikörper Donanemab bekannt gegeben: Der Antikörper verlangsamte die klinische Verschlechterung von Patienten im Alzheimer-Frühstadium signifikant. Allerdings können schwere Nebenwirkungen wie Hirnschwellungen und Blutungen auftreten.
Nach der umstrittenen Zulassung Aducanumabs (Aduhelm™) vor zwei Jahren und der Zulassung Lecanemabs (Leqembi™) Anfang des Jahres durch die US-amerikanische Arzneimittelbehörde FDA steht nun der dritte Alzheimer-Antikörper in den Startlöchern: Der Hersteller Eli Lilly gab am 3. Mai 2023 vorläufige Ergebnisse zur Phase-III-Studie mit seinem Anti-Amyloid-Antikörper Donanemab in einer Pressemitteilung bekannt [1]. Der humanisierte IgG1-Antikörper richtet sich spezifisch gegen ein nur in abgelagerten Plaques anzutreffendes Pyroglutamat-Epitop des Beta-Amyloids. Die Ablagerungen im Gehirn der Alzheimer-Erkrankten sind Kardinalzeichen und der Amyloid-Hypothese nach auch Ursache der Erkrankung.
Mehr zum Thema
Alzheimertherapie
Alzheimer-Antikörper Lecanemab von der FDA zugelassen

Keine Zulassung in Europa
US-Krankenversicherung begrenzt Einsatz von Alzheimer-Antikörper Aducanumab
Demenz: 126 Wirkstoffkandidaten, nur eine Zulassung
Die tröpfelnde Pipeline
In der TRAILBLAZER-ALZ-2-Studie wurde der Antikörper bei 1182 Alzheimer-Patienten (65 bis 85 Jahre) im frühen Krankheitsstadium mit nur leichten Symptomen getestet. Die Therapie wurde allerdings nicht während der gesamten Studiendauer aufrechterhalten, sondern beendet, sobald die Amyloid-Plaques der Probanden in Positronen-Emissionstomografien auf eine bestimmte Menge reduziert wurden: Nach sechs Monaten schmolzen die Ablagerungen bei 34 Prozent und nach zwölf Monaten bei 71 Prozent der Patienten auf ein Alzheimer-negatives Maß. Zur Quantifizierung der Alzheimer-Symptome erhoben die Wissenschaftler als primären Endpunkt die integrated Alzheimer‘s Disease Rating Scale (iADRS). Die Skala beurteilt sowohl die kognitiven Fähigkeiten als auch die Alltagsfähigkeit der Patienten. Donanemab bremste die so gemessene klinische Verschlechterung der Patienten zum Studienende nach 18 Monaten signifikant um 35 Prozent gegenüber Placebo ab (p < 0,0001).
In der Studie zeigte sich, dass der Antikörper am besten wirkte, wenn gleichzeitig nur moderate Mengen an Tau-Fibrillen, das zweite Kardinalzeichen der Krankheit, in den Gehirnen der Probanden abgelagert waren. Wenn, gemessen an den Tau-Ablagerungen, 552 schwer erkrankte Patienten mit in die Bewertung einbezogen wurden, war das Fortschreiten der Erkrankung in der gesamten Population gegenüber Placebo aber immer noch um 22 Prozent verlangsamt (p < 0,0001).
Schritt in die richtige Richtung – aber mit Nebenwirkungen teuer erkauft?
In der Fachwelt wurden die Ergebnisse überwiegend optimistisch aufgenommen: „Die Ergebnisse der Pressemitteilung zu Donanemab schauen wirklich sehr gut aus“, so Prof. Dr. Christian Haas, Standortsprecher des Deutschen Zentrums für neurodegenerative Erkrankungen e. V. in München gegenüber dem Science Media Center. In Anbetracht der Resultate stellte er klar, dass die Amyloid-Hypothese keine Hypothese mehr sei, sondern ein Fakt. Dr. Linda Thienpont, wissenschaftliche Leiterin der Alzheimer Forschung Initiative e. V., sieht in dem Antikörper zwar keinen Gamechanger, aber einen Schritt in die richtige Richtung, der jedoch mit den Nebenwirkungen teuer erkauft wurde.
Sogenannte Amyloid-Related Imaging Abnormalities, kurz ARIA, treten als unerwünschte Veränderungen in MRT-Scans auf und gelten als Klasseneffekt der Anti-Amyloid-Antikörper. In der Donanemab-Gruppe beobachteten die Studienärzte bei 24,0 Prozent der Probanden entsprechende Schwellungen und bei 31,4 Prozent (bzw. bei 13,6 Prozent in der Placebogruppe) Mikroblutungen bzw. Eisen-Ablagerungen. Meist sind diese Veränderungen harmlos, aber bei 1,6 Prozent der Probanden waren sie schwerwiegend. Zwei Probanden starben nachgewiesenermaßen daran, ein weiterer, nachdem eine schwere ARIA auftrat.
Ausführliche Ergebnisse werden noch in einem wissenschaftlichen Fachjournal mit Peer-Review zu lesen sein. Eli Lilly arbeitet daran, die nötigen Daten zur Zulassung noch in diesem Quartal bei der FDA einzureichen.
Literatur
[1] Lilly‘s Donanemab Significantly Slowed Cognitive and Functional Decline in Phase 3 Study of Early Alzheimer‘s Disease. Pressemitteilung Eli Lilly vom 3. Mai 2023, investor.lilly.com/news-releases/news-release-details/lillys-donanemab-significantly-slowed-cognitive-and-functional
[2] Alzheimer-Antikörper Donanemab ist klinisch wirksam. Meldung des Science Media Centers vom 3. Mai 2023






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.