
- DAZ.online
- News
- Pharmazie
- Ohne Tierversuche – Aus...
In vitro-Verfahren statt Kaninchentest
Ohne Tierversuche – Aus für die letzten Kaninchentests bis 2026
Düsseldorf - 16.03.2023, 11:00 Uhr

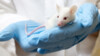
Der Test am Kaninchenmodell ist seit einiger Zeit nicht mehr in den nationalen Pharmakopöen in Europa und den USA vorgeschrieben – es gibt schließlich Alternativen. (Foto: Artem / AdobeStock)
Der Pyrogentest an Kaninchen soll im Rahmen einer Überarbeitung der entsprechenden Kapitel und Abschnitte aus dem Europäischen Arzneibuch verschwinden. Eine Kommentierung der neuen Texte ist noch bis Ende März 2023 möglich. Bis Ende 2026 sollen dann alle noch laufenden Tierversuche durch andere Verfahren ersetzt werden.
Alle Arznei- und Heilmittel, die parenteral gegeben werden, unterliegen aus gutem Grund hohen Sicherheitsstandards. Dazu gehört unter anderem ein Test auf Stoffe, die Fieber auslösen können: Pyrogene. Von exogenen Pyrogenen wie Bakterientoxinen bis hin zu Gummiabrieb oder Metallverbindungen in Elastomeren reicht die Liste der möglichen Verunreinigungen. Aber auch bakterielle Endotoxine, also Bestandteile der äußeren Zellmembran gramnegativer Bakterien, zählen zu den Pyrogenen.
Mehr zum Thema

Was ist drin?
Wie man Kosmetik ohne Tierversuche erkennen kann
Der wohl älteste dieser vorsorglichen und vorgeschriebenen Tests ist der Kaninchentest, der bereits im Jahr 1910 Einzug in das britische Arzneibuch, die Britische Pharmakopöe (BP), fand. Bei diesem auch als RPT – Rabbit Pyrogen Test – bekannten Verfahren injiziert man mehreren Tieren eine zu testende Lösung in die Ohrrandvene. Regelmäßig misst man dabei die Temperatur der Kaninchen. Als pyrogenfrei gilt eine Prüflösung, wenn bei mindestens drei Tieren die Summe der Temperaturabweichung nach der Injektion zwischen Anfangs- und Höchsttemperatur nicht mehr als 1,15 Kelvin entspricht.
In vitro-Verfahren statt Kaninchentests
Außer, dass dieser Test am Kaninchenmodell zwar alle bekannten und unbekannten Pyrogene umfasst, aber dennoch nicht vollständig auf Menschen übertragbar ist, hat er den großen Nachteil, dass es sich um einen Tierversuch handelt. Denn diese sollen, so der politische und ethische Wille, möglichst reduziert werden. 3R ist dabei das Stichwort, also „Replacing, Reducing and Refining“ (Ersetzen, Vermindern und Verbessern). Aus diesem Grund ist der Test bereits seit einiger Zeit nicht mehr in den nationalen Pharmakopöen in Europa und den USA vorgeschrieben – es gibt schließlich Alternativen. Dennoch gibt es immer noch Unternehmen, die den RPT einsetzen. Damit soll nun aber wohl bis Ende 2026 innerhalb der Europäischen Union endgültig Schluss sein.
Denn der RPT soll auch aus der European Pharmacopoeia (Ph. Eur.) – dem Europäischen Arzneibuch – gestrichen werden. So beschloss es die Europäische Arzneibuchkommission bereits im Jahr 2021. Im Sinne der 3R-Strategie, die Tierversuche letztlich auf ein Mindestmaß zurückfahren soll, versucht die EU bereits seit 1986 in entsprechenden Vorschriften Änderungen durchzusetzen. Damals verabschiedete man die „European Convention for the Protection of Vertebrate Animals used for Experimental and other Scientific Purposes“ – also die „Europäische Konvention zum Schutz von Wirbeltieren, die für experimentelle und andere wissenschaftliche Zwecke verwendet werden“.
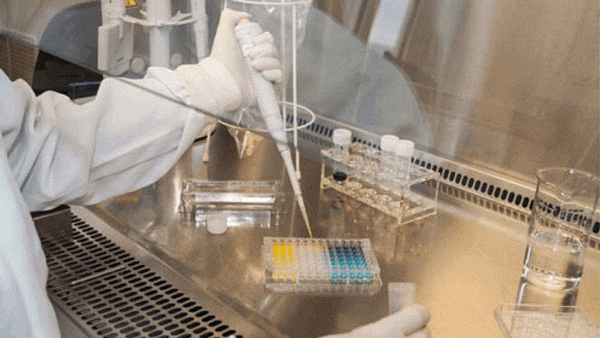
Zukünftig sollen alle Tests auf Pyrogene nur noch mit in vitro-Verfahren erfolgen. Zwei alternative Verfahren zum RPT gibt es, die auch bereits in großem Maßstab eingesetzt werden. Nicht unumstritten ist dabei der sogenannte BET oder LAL-Test. Das steht für Bakterien-Endotoxin-Test beziehungsweise Limulus-Amöbozyten-Lysat-Test. Der Test ist rund 100-mal sensitiver als der RPT, reagiert allerdings nur auf Bakterien-Endotoxine. Diese machen jedoch den Hauptteil der möglichen Verunreinigungen mit Pyrogenen aus.
Alternative LAL ist ebenfalls umstritten
Was diesen Test umstritten macht, ist, dass dazu sogenannte Amöbozyten aus dem Blut von Pfeilschwanzkrebsen der Arten Limulus polyphemus oder Tachypleus tridentatus gewonnen werden müssen. Diese urtümlichen Krebsarten stehen unter Artenschutz und werden zwar lebend gefangen und nach der Entnahme wieder freigelassen – die Mortalität der so behandelten Tiere ist mit bis zu 30 Prozent jedoch hoch.
Der Test an sich basiert darauf, dass die Amöbozyten – primitive Immunzellen der über 440 Millionen Jahre alten Arten – in Anwesenheit von Bakterien-Endotoxinen wie etwa Lipopolysachariden aus der Bakterienwand koagulieren, was sich photometrisch messen lässt. Der Test wurde in den 1970er Jahren zunächst an Limulus-Blut, dann an lysierten Amöbozyten entwickelt. Seit dem Jahr 2003 existiert aber auch ein LAL-Test, der auf gentechnisch hergestelltem Protein aus den Amöbozyten basiert. Dieser findet sich seit 2020 auch im Ph.Eur.
Die andere von vielen als besser angesehene Alternative ist der Monozyten-Aktivierungstest (MAT), bei dem in vitro humane Monozyten mit den Testlösungen reagieren. Gemessen wird dabei die natürliche Fieberreaktion, bei der die Monozyten nach dem Kontakt mit Pyrogenen Botenstoffe freisetzen. Der Test ist seit dem Jahr 2009 in der Ph.Eur. verzeichnet und gilt seit 2013 als international validiert. Ein weiterer Vorteil ist, dass der MAT alle Arten von Pyrogenen erfassen kann.
Kommentierung der neuen Ph.Eur.-Texte noch bis 31. März möglich
Um den RPT vollständig aus dem Europäischen Arzneibuch zu tilgen – und ihn damit in Europa faktisch nicht mehr zulassungsfähig zu machen – fährt die Europäische Arzneibuchkommission nun eine ganz neue Pyrogen-Strategie, heißt es etwa in einer Veröffentlichung aus dem September 2022. So wurde in die Europäische Pharmakopöe etwa ein neues Kapitel „5.1.13. Pyrogenicity“ eingeführt, das Pyrogenität und die dazu verwendeten Tests neu definiert. Die rund 60 Stellen in dem Gesamtwerk, in denen es einen Bezug zum RPT gibt, sollen ebenfalls bis spätestens Juli 2026 ausgetauscht sein.
Europäische Arzneimittelagentur
Mehr Hilfe zur Minimierung von Tierversuchen während der Arzneimittelentwicklung

PEI-Forscherinnen ausgezeichnet
Es geht auch ohne Tierversuch
Insgesamt sind 59 Texte, ein Haupttext – eben jenes neue Kapitel 5.1.13. – sowie 58 überarbeitete Texte bereits zur Kommentierung veröffentlicht. Wer noch einen Kommentar dazu abgeben will, hat allerdings nur noch bis zum 31. März 2023 Zeit. Dann endet die Kommentar-Frist.
Durchaus positiv sieht das deutsche Paul-Ehrlich-Institut – in Deutschland zuständig für Impfstoffe und biomedizinische Arzneimittel – die neue Strategie der Europäischen Arzneibuchkommission. In einer Stellungnahme bereits aus dem Jahr 2020 betonte es etwa, dass schon im Jahr 2018 einem deutschen Anbieter von Pyrogentests die Genehmigungsverlängerung für RPTs verweigert worden sei.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.