
- DAZ.online
- News
- Pharmazie
- Tschüss Cytotec! Hallo ...
Misoprostol in der Geburtseinleitung
Tschüss Cytotec! Hallo Angusta?
Stuttgart - 01.02.2021, 17:50 Uhr

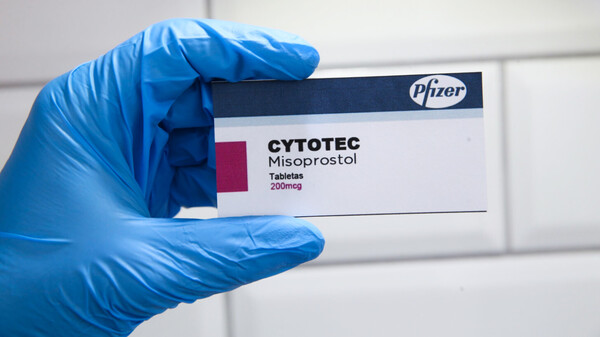
Egal ob Angusta noch in diesem Jahr auf den deutschen Markt kommt – Cytotec soll unabhängig davon nicht zur Geburtseinleitung verwendet werden, da die Dosierung mit 200 µg viel zu hoch ist, meint die DGGG. (Foto: Gorodenkoff / stock.adobe.com)
Zulassung von Angusta in Deutschland: die „Repeat-Use Procedure“
Am 17. August 2020 veröffentlichte nun die Firma Norgine B.V. eine Pressemitteilung mit der Botschaft, einen wichtigen Meilenstein in der Zulassung von Angusta® (Misoprostol) in Europa zur oralen Einleitung der Wehen erreicht zu haben. Man habe die sogenannte „Repeat-Use Procedure“ (RUP) in einer Reihe europäischer Länder abgeschlossen: darunter Österreich, Belgien, Zypern, Deutschland, Griechenland, Spanien, Irland, Italien, Luxemburg, Malta, Niederlande, Portugal und Großbritannien. Während den meisten Pharmazeut:innen noch geläufig sein dürfte, was eine Mutual Recognition Procedure (MRP) ist, ist die RUP wahrscheinlich erklärungsbedürftig.
Die DAZ 38/2014 erklärte zur Zulassung in Europa: „Für Arzneimittel, die nicht unter den Anwendungsbereich des zentralen Verfahrens fallen, muss, wenn sie in mehreren Mitgliedstaaten zur Zulassung gebracht werden sollen, entweder das Verfahren der gegenseitigen Anerkennung (MRP) oder das dezentrale Verfahren (DCP) beschritten werden.“ In beiden Verfahren kann der Antragsteller demnach die Länder, in denen er die Zulassung anstrebt, selbst bestimmen. Das BfArM erklärt zusätzlich auf seinem Internetauftritt: „Soll ein Präparat, welches schon ein DCP oder ein erstes MRP durchlaufen hat, in einem oder mehreren weiteren EU-Staaten in den Verkehr gebracht werden, muss zwingend ein weiteres MRP durchgeführt werden. Dieses Verfahren ist bekannt als sogenanntes Repeat Use Procedure (RUP).“
Mehr zum Thema
Teil 2: Europäisches Zulassungssystem, Änderungen an Arzneimitteln nach der Zulassung
Arzneimittelzulassung
Dieses RUP hat Angusta® für Deutschland also erfolgreich durchlaufen. Auf dem Markt verfügbar ist es laut Lauer-Taxe (Stand. 28.01.2021) allerdings nur in Österreich und den Niederlanden durch die Firma Norgine – und in Dänemark durch die Firma Azanta, welche laut der Pressemitteilung kürzlich durch Norgine übernommen wurde. Dementsprechend diente Dänemark – als Mitgliedstaat, in welchem die Zulassung bereits vorlag – auch im Rahmen der RUP automatisch als sogenannter „Reference Member State“.
Abweichend zur Verfügbarkeit laut Lauer-Taxe heißt es in der Norgine-Pressemitteilung, dass Angusta® in Europa bereits 2017 in einer Reihe von nordischen Ländern, Frankreich und zehn weiteren mittel- und osteuropäischen Ländern zugelassen wurde.




























1 Kommentar
Theorie und Praxis
von Karola Neuhaus am 03.02.2021 um 15:54 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Das Kommentieren ist aktuell nicht möglich.