
- DAZ.online
- News
- Pharmazie
- Fristverlängerung für ...
Frühe Nutzenbewertung
Fristverlängerung für Cannabis-Extrakt
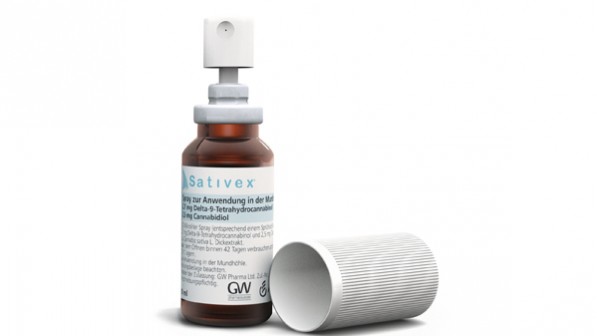
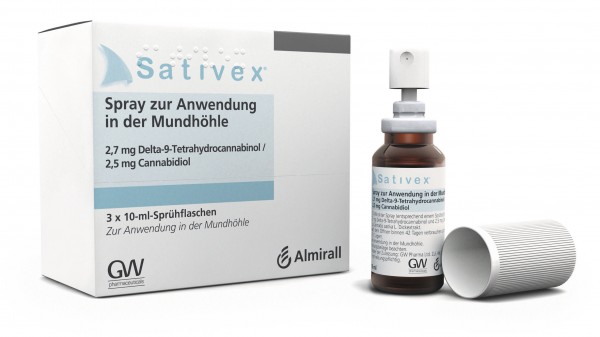
Im Juni 2012 hatte der Gemeinsame Bundesausschuss (G-BA) Sativex®, dem einzigen Cannabis-Fertigarzneimittel im deutschen Markt, einen Anhaltspunkt für einen geringen Zusatznutzen gegenüber der zweckmäßigen Vergleichstherapie attestiert. Er hatte seinen Beschluss zur frühen Nutzenbewertung seinerzeit auf drei Jahre begrenzt – in der Erwartung, dass in dieser Zeit weitere wissenschaftliche Erkenntnisse zu dem bei Multipler Sklerose eingesetzten Arzneimittel gewonnen werden. Nun hat der G-BA dem Hersteller nochmals Aufschub gegeben und die Frist um ein Jahr verlängert.
Sativex® ist ein Arzneimittel in Form eines Mundspray mit Extrakt aus Cannabis sativa (Wirkstoffkombination Delta-9-Tetrahydrocannibol und Cannabidiol). Es ist zugelassen zur Symptomverbesserung bei Patienten mit mittelschwerer bis schwerer Spastik aufgrund von Multipler Sklerose (MS). In der zuletzt verstärkt geführten Debatte um Cannabis als Arzneimittel äußerte manch einer die Erwartung, dass Sativex® auch in anderen Indikationen wirksam ist. Bundesärztekammer-Präsident Frank Ulrich Montgomery etwa hält die Zulassung auch für andere Indikationen für „sinnvoll und wünschenswert“.
Mit überzeugenden Studien tut sich der Hersteller Almirall aber offenbar schwer – auch drei Jahre nach dem ersten Nutzenbewertungsbeschluss liegt keine weitere vor. Dabei sollte ihm der Nachweis eines Zusatznutzens am Herzen liegen. Schließlich muss er sich gegenwärtig mit einem Erstattungsbetrag begnügen, den die Schiedsstelle festgesetzt hat – und der liegt deutlich unter dem Preis, den der Hersteller noch im ersten Jahr nach der Markteinführung verlangt hatte. Doch Almirall hat eine weitere Studie angekündigt.
Fristverlängerung unter Auflagen
Um deren Einbeziehung in die Nutzenbewertung nach Fristablauf zu ermöglichen, wird die ursprünglich bis zum 21. Juni 2015 befristete Geltungsdauer des ersten Beschlusses nun bis zum 1. Juni 2016 verlängert, heißt es im aktuellen G-BA-Beschluss. Verbunden ist die Fristverlängerung mit der Auflage an Almirall, innerhalb eines Jahres nachzuweisen, dass mindestens der erste Patient in die für die erneute Nutzenbewertung geplante Studie eingeschlossen wurde. Kann der pharmazeutische Unternehmer dies zum Ablauf der Befristung nachweisen, prüft der G-BA, ob eine weitere Verlängerung der Geltungsdauer des Beschlusses entsprechend der Studiendauer sachgerecht ist.
Erfüllt der pharmazeutische Unternehmer die Auflage jedoch nicht oder kommt der G-BA zu dem Ergebnis, dass eine weitere Fristverlängerung nicht sachgerecht ist, beginnt das Verfahren der Nutzenbewertung erneut, wenn die Frist abgelaufen ist. Hierzu hat der pharmazeutische Unternehmer spätestens am Tag des Fristablaufs beim G-BA ein Dossier zum Beleg eines Zusatznutzens von Extrakt aus Cannabis sativa im Verhältnis zur zweckmäßigen Vergleichstherapie einzureichen. Geschieht dies nicht, kann der G-BA die Feststellung treffen, dass ein Zusatznutzen nicht belegt worden ist.
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.